武汉康测科技有限公司
9 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.5
- 0.5
- 1.5
- 0.5
公司新闻/正文
康测科技UID RNA-seq助力华中科技大学吴孔明教授团队发表Journal for ImmunoTherapy of Cancer
1761 人阅读发布时间:2023-02-03 17:28
康测科技UID RNA-seq助力华中科技大学吴孔明教授团队发表Journal for ImmunoTherapy of Cancer

引言
11月的一篇文献解读(转录因子和组蛋白修饰酶手牵手,癌症转移快快有!)介绍FOXQ1-RbBP5结合可以提升共同靶标基因启动子区H3K4me3修饰水平和激活EMT相关基因转录导致TNBC亚型,本次带来的是康测科技客户的文章,刚好也是研究乳腺癌,只不过侧重点不在机制,而在治疗方面,该客户制作了一种双特异性抗体BiTP同时靶向PD-L1和TGF-β,通过抗体性能评估以及动物治疗结果的测试,发现BiTP在TNBC动物模型中的抗肿瘤活性及其潜在机制。
研究背景
乳腺癌是女性健康的主要威胁,2020年造成全球近68500人死亡。其中三阴性(TNBC)是最具侵袭性的乳腺癌亚型,缺乏有效治疗药物的特定靶点。尽管免疫检查点疗法,即抗PD-1/PD-L1疗法彻底改变了TNBC的治疗模式,但抗PD-1/PD-L1疗法的低反应率尚未得到很好的解决。PD-1/PD-L1的治疗效果受到多种免疫抑制因素的阻碍,包括TGF-β。对于正常组织和早期乳腺癌,TGF-β通过诱导细胞周期停滞和凋亡来充当肿瘤抑制因子。然而,对于晚期乳腺癌,TGF-β通过增强转移,放疗或化疗耐药性以及肿瘤微环境(TME)重编程来促进肿瘤进展。本研究构建了靶向TGF-β和PD-L1的双特异性抗体(称为BiTP),并探讨了BiTP在TNBC中的抗肿瘤作用。结果标明BiTP在TNBC模型中表现出体外生物活性和有效的抗肿瘤活性,是进一步进行临床研究的有希望的候选药物。
研究结果
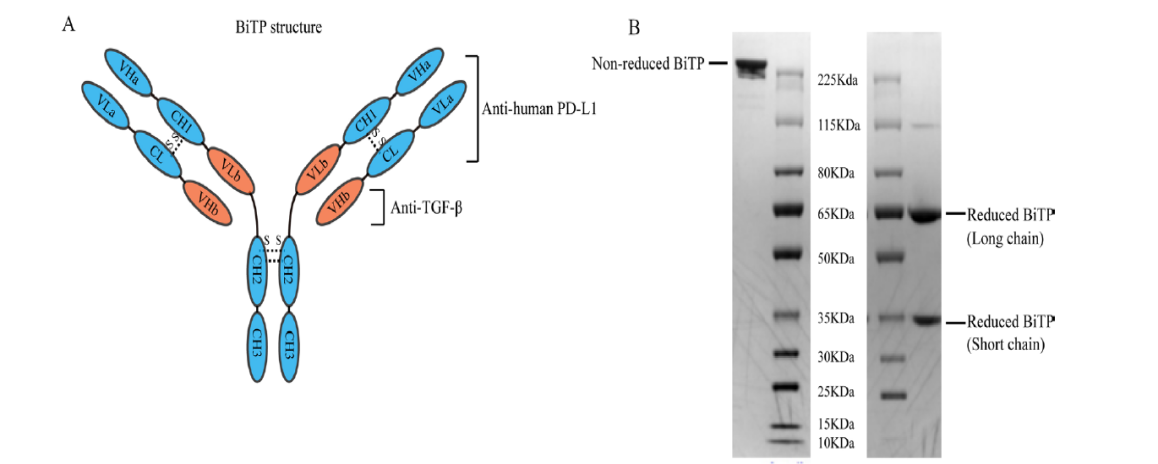
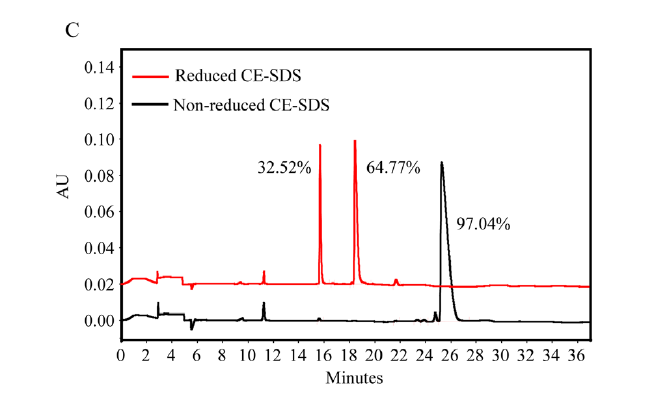
1.BiTP的结构和结合能力作为IgG1/IgG2杂交抗体,BiTP的Fc片段包含由 IgG2 衍生的 CH2 结构域和由IgG1 衍生的 CH3 结构域,通过D270A替换以降低与 FcγR 的结合亲和力。并且没有观察到BiTP有显著抗体依赖性细胞介导的细胞毒性。VLa,CL,VHa和CH1均来源于抗人PD-L1的相应结构域。 VHb和VLb结构域来源于抗TGF-β的相应结构域(如下图A)。还原性SDS-PAGE显示BiTP由短链和长链组成(如下图B)。CE-SDS表明纯度超过97%(如下图c)此外,BiTP的分子量约为201.5KDa(短链:37.3KDa;长链:63.4KDa)。
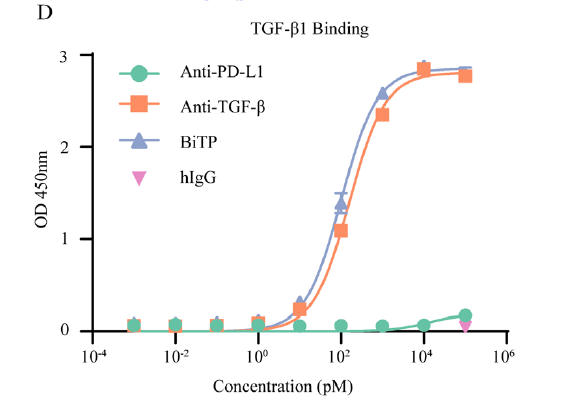
与TGF-β抗体相比,BiTP与预涂平板上的TGF-β结合,其结合亲和力相似或稍弱(如下图D-F)。并且BiTP与H358细胞(高水平表达PD-L1)结合,具有与PD-L1抗体相似的结合亲和力(如下图G)。双抗原夹心ELISA显示TGF-β1捕获的BiTP同时与PD-L1结合(图H)。
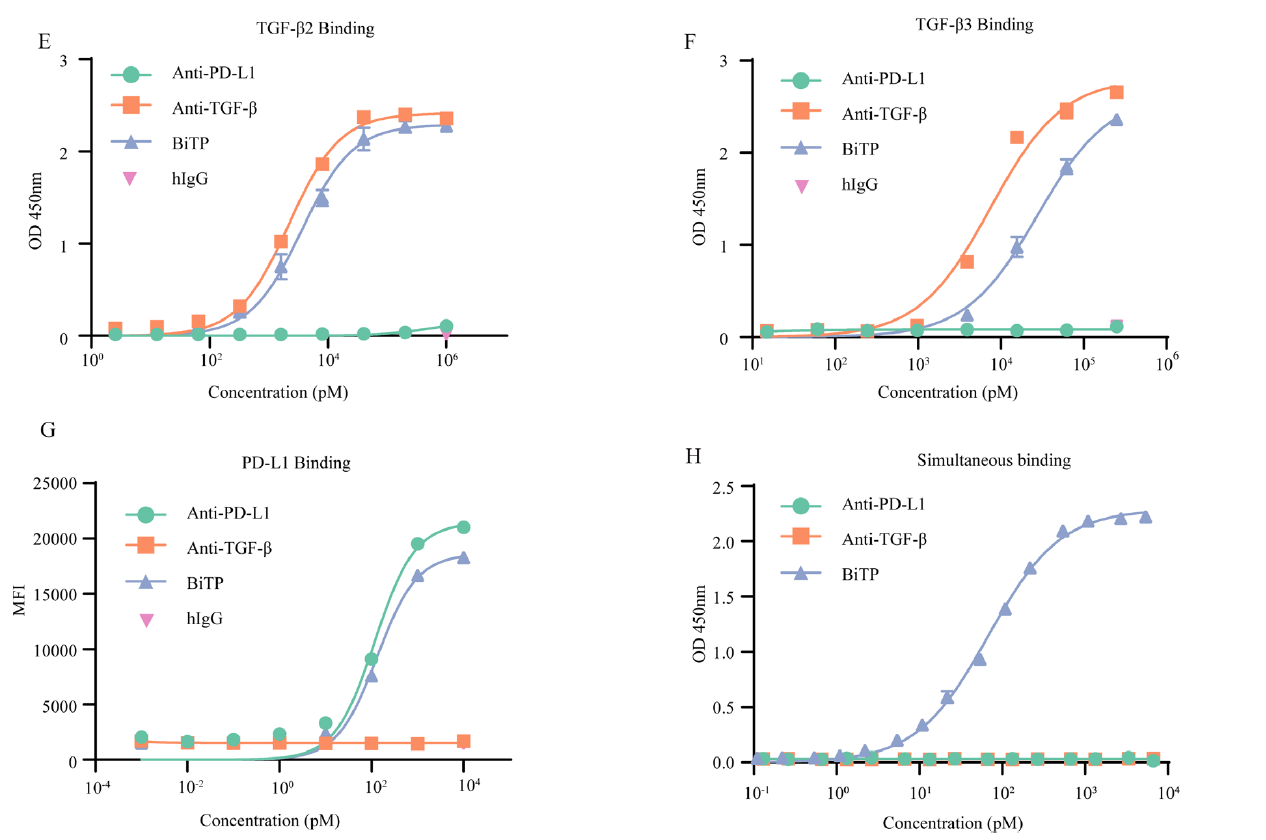
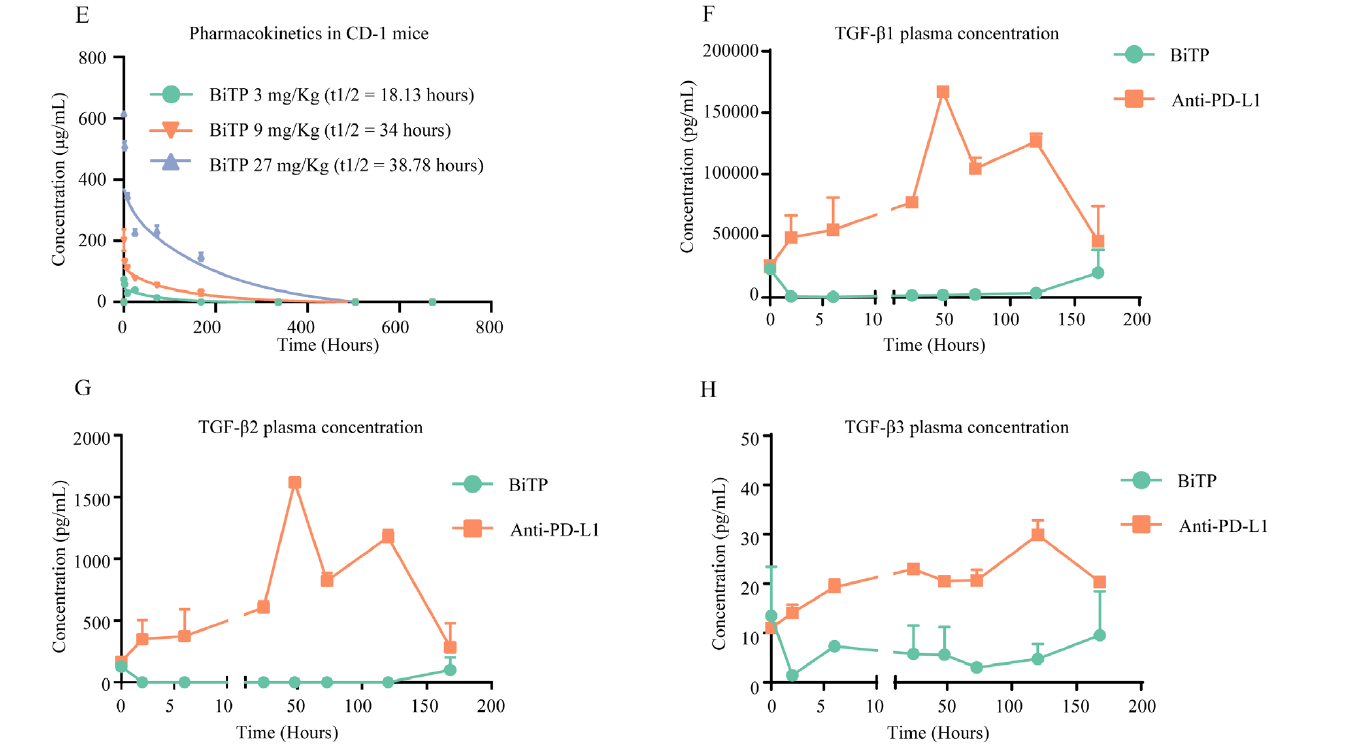
2.血浆中的药物代谢动力学研究
作者研究发现BiTP在CD-1小鼠中表现出非线性药物代谢动力学。在9mg/kg的剂量下,BiTP的半衰期(t1/2)为34小时(如下图E)。在单剂量BiTP后的μMT小鼠中,其血浆中的TGF-β1和TGF-β2在2至120小时几乎完全耗尽(如下图F-G)。然而BiTP处理后的TGF-β3的浓度在所有时间点都保持在较低水平(如下图H)。
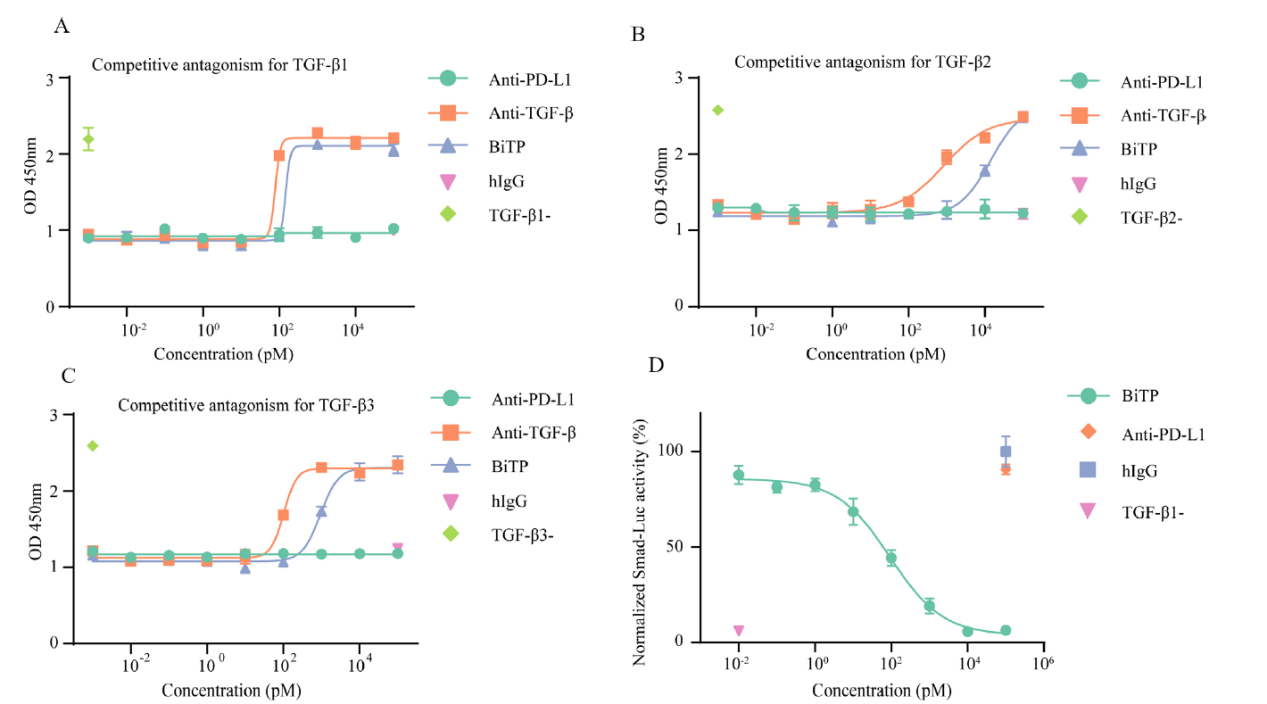
3.BiTP抗TGF-β 和PD-L1的生物活性
TGF-β的生物学活性可以通过TF-1增殖试验来确定,结果显示BiTP可以通过剂量依赖的方式逆转TGF-β引起的TF-1增殖损伤(如下图 A-C)。此外,BiTP 有效地阻断了典型的 TGF-β-Smad信号传导(如下图 D)。
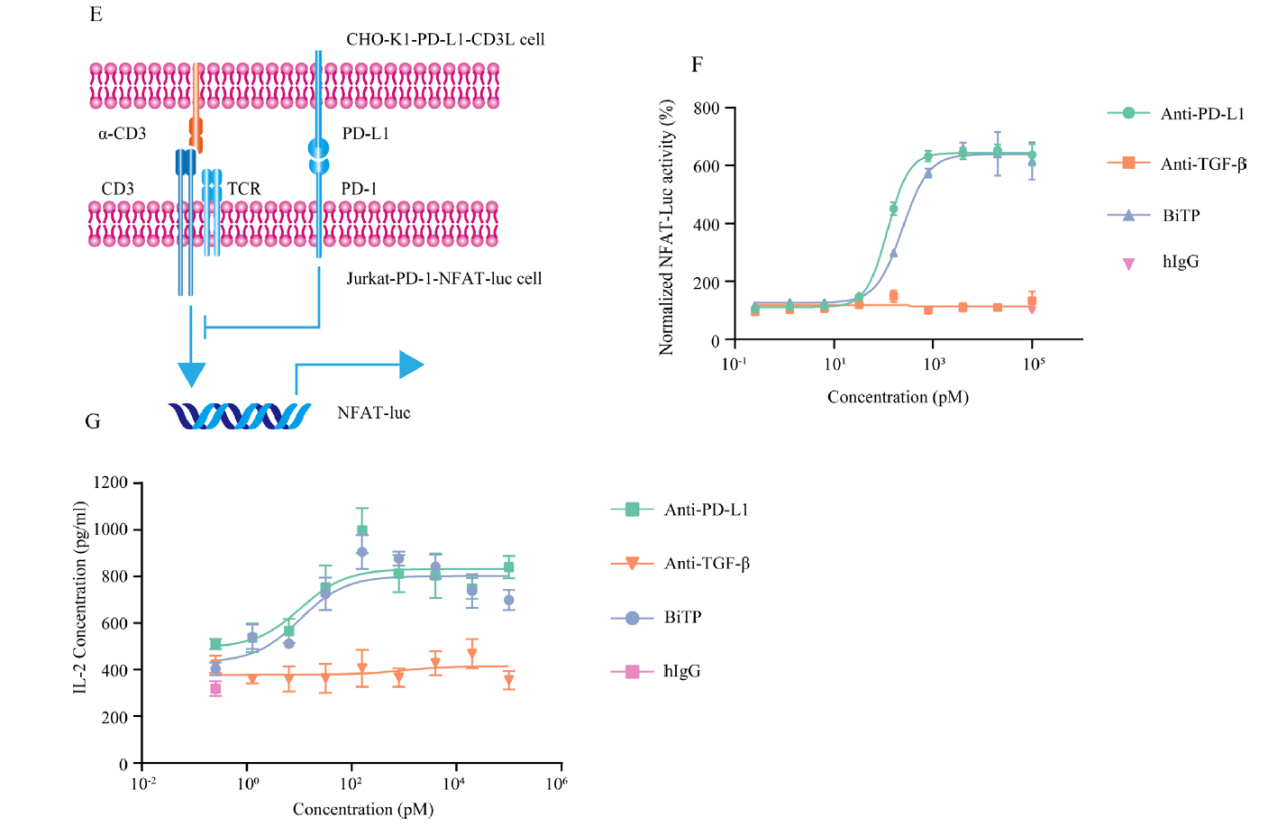
对BiTP的抗PD-L1部分的生物活性作者通过含有Jurkat-1-PD-1-NFAT-Luc和CHO-K1-PD-L1-CD3L细胞的荧光素酶报告系统进行了评估(如下图E)。发现BiTP抵消了PD-1/PD-L1通路介导的对NFAT信号传导的抑制(如下图F)。且在超级抗原刺激测定中,BiTP增强了IL-2的分泌(如下图G)。T细胞活性的增强与BiTP的剂量有关,高剂量的BiTP表现出更强的促进T细胞活化的能力。
4.BiTP在小鼠模型中的抗肿瘤活性
作者在EMT 6-hPDL1和4T1-hPDL1模型中评估了BiTP的抗肿瘤作用。肿瘤细胞接种一周后,将小鼠分组并用6种剂量的抗体进行治疗。在两种TNBC模型中,BiTP表现出优于亲本抗体的抗肿瘤活性。与其他三组相比,BiTP还显著减缓了肿瘤生长并延长了荷瘤小鼠的存活期(如下图A-H)。
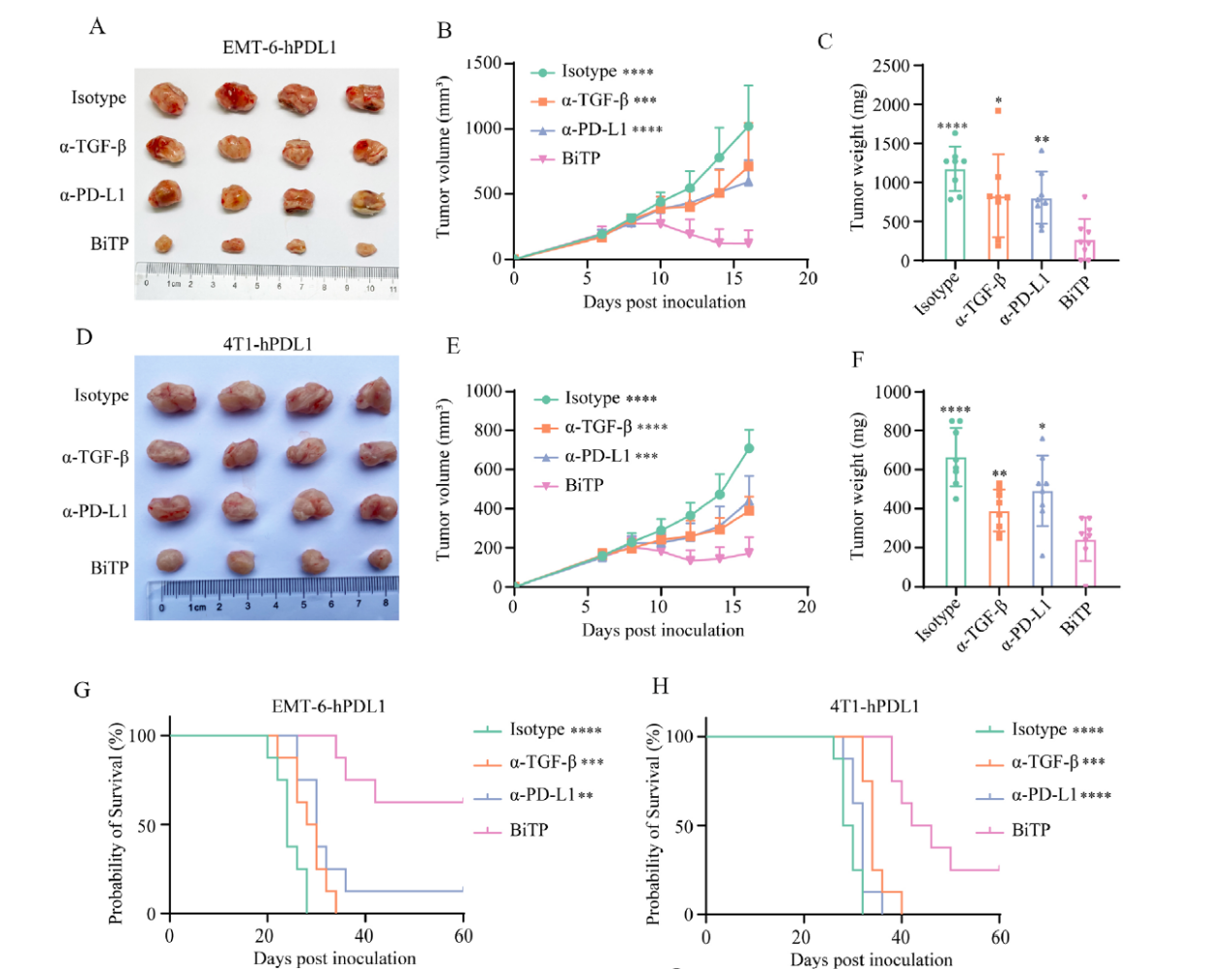
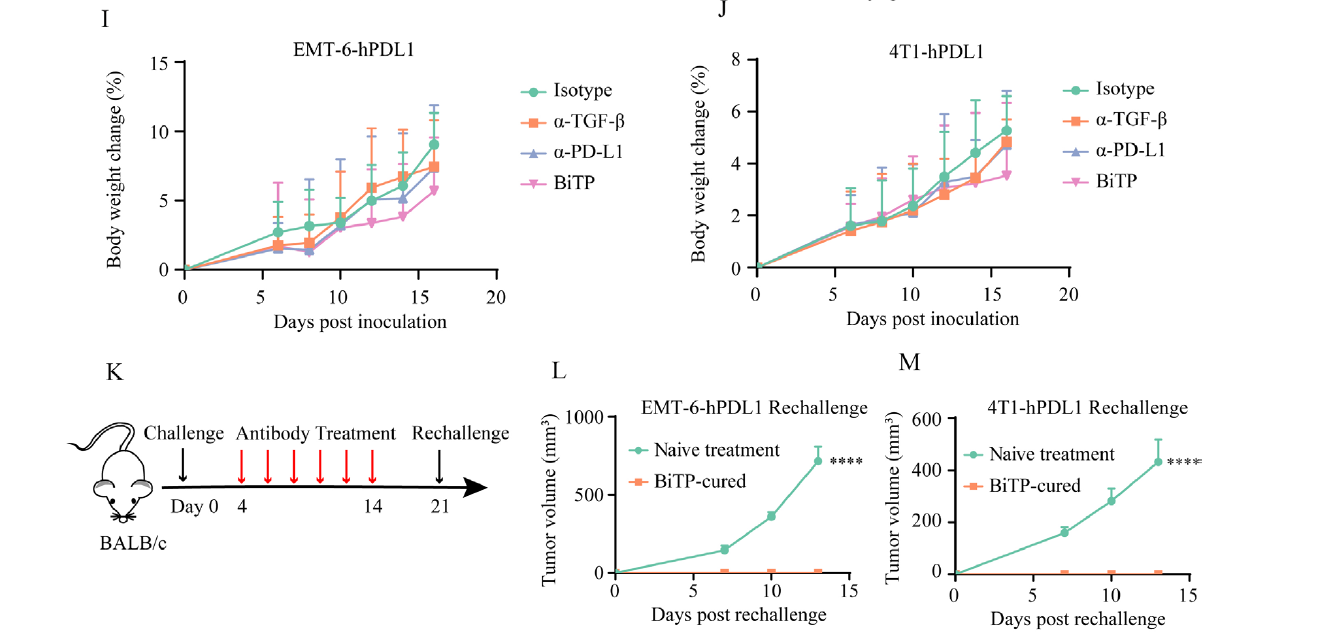
作者并未观察到接受抗体治疗的小鼠有明显的毒性和体重减轻现象,这表明BiTP的安全性和耐受性是可接受的(如下图I-J)。再激发试验显示,所有BiTP治愈的小鼠都排斥了再次接种的肿瘤,表明BiTP建立了有效的抗肿瘤免疫记忆(如下图K-M)。
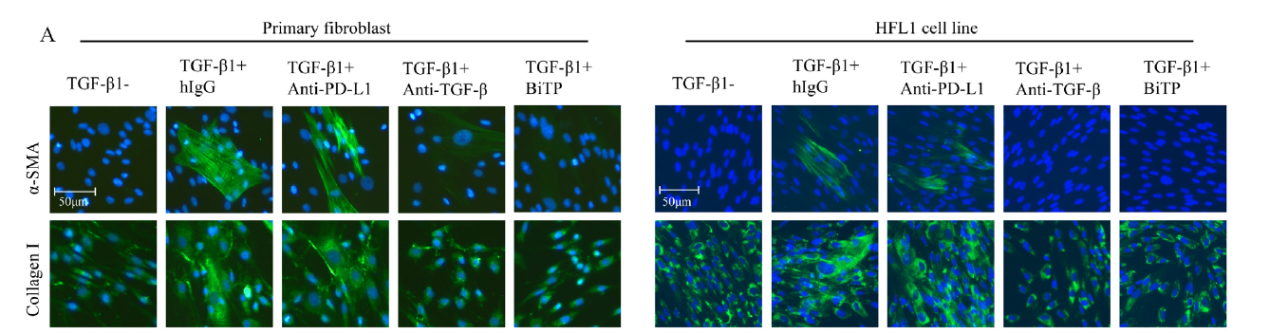
5.BiTP抑制胶原蛋白生成,促进T细胞浸润
此前研究表明,TGF-β阻断是通过限制CAF衍生的胶原蛋白来增强T细胞浸润的。鉴于CAF来源的胶原蛋白会破坏T细胞渗透,作者首先探讨了BiTP对体外CAF活性的影响。由于α-SMA是CAF的标志物,对于原代成纤维细胞和HFL1,TGF-β1增强α-SMA表达和I型胶原蛋白的生成(如下图A)。同时,BiTP处理可拮抗TGF-β1引起的α-SMA和I型胶原蛋白的表达上调。
接下来,作者研究了4T1-hPD-L1肿瘤中的CAF活性和CD8+ T细胞浸润。α-SMA抗体染色显示BiTP和TGF-β抗体可以下调α-SMA 表达水平,表明 CAF 活性受到限制(如下图 B)。Picrosirius染色显示,BiTP和TGF-β抗体处理后胶原蛋白生成显着减少(如下图C)。
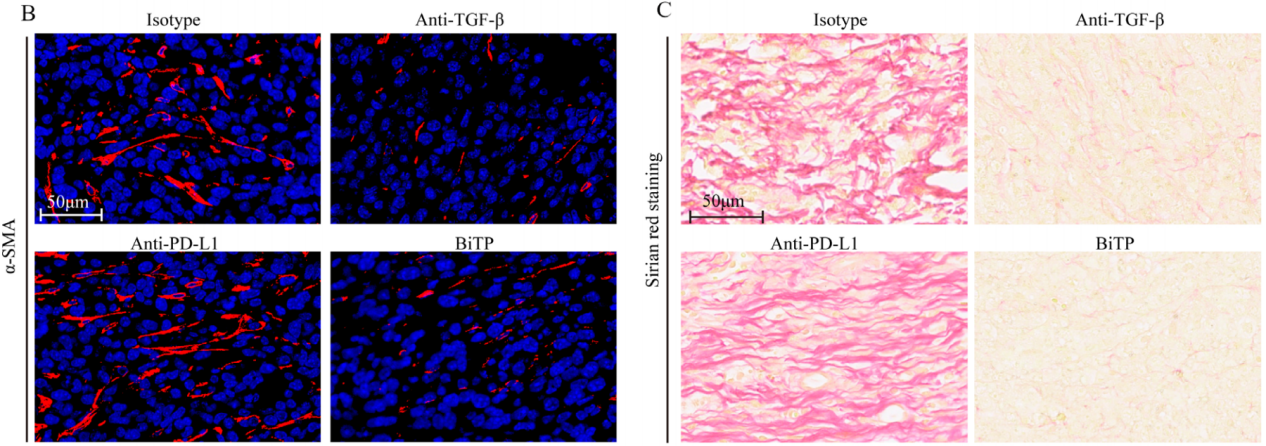
随后使用CD8抗体染色以研究免疫浸润状态,结果显示对于用hIgG或抗PD-L1治疗的小鼠,大多数CD8像素位于肿瘤边缘。相比之下,对于使用TGF-β抗体或BiTP治疗的小鼠,更多的CD8像素位于肿瘤中心位置(如下图D)。
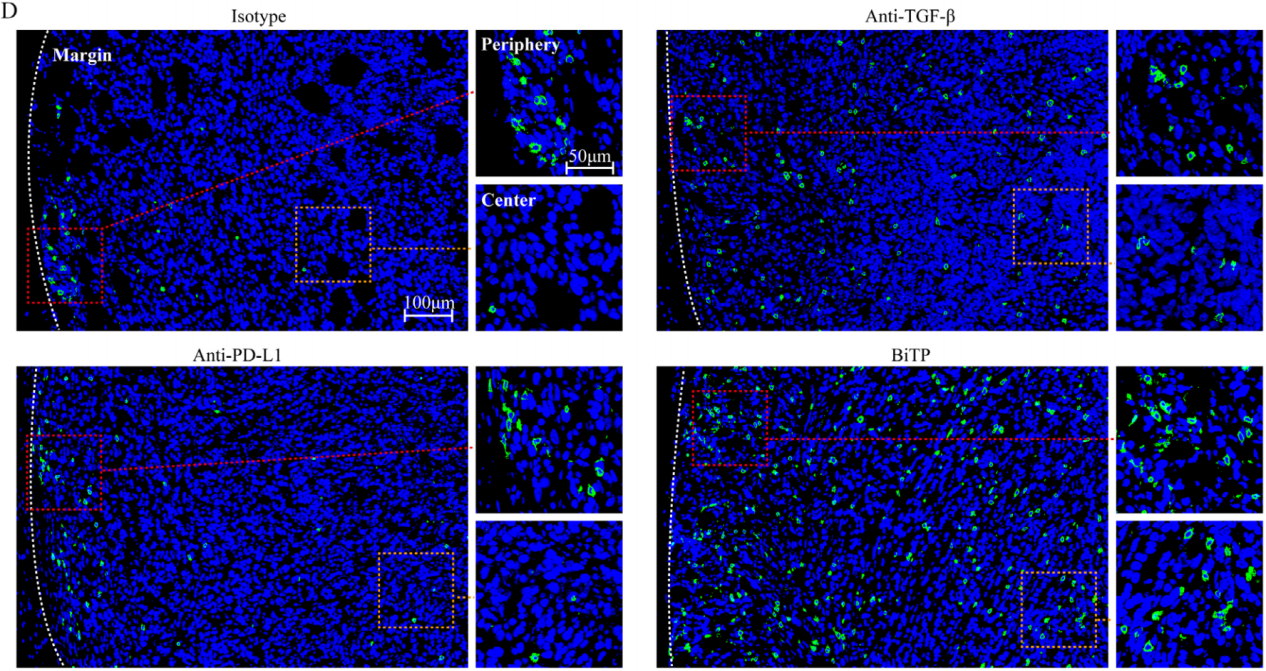
定量分析表明,BiTP扩大了T细胞群并增加了其浸润深度。总的来说,BiTP抑制了CAF活性,减少了胶原蛋白沉积,并增强了T细胞浸润(如下图E-H)。
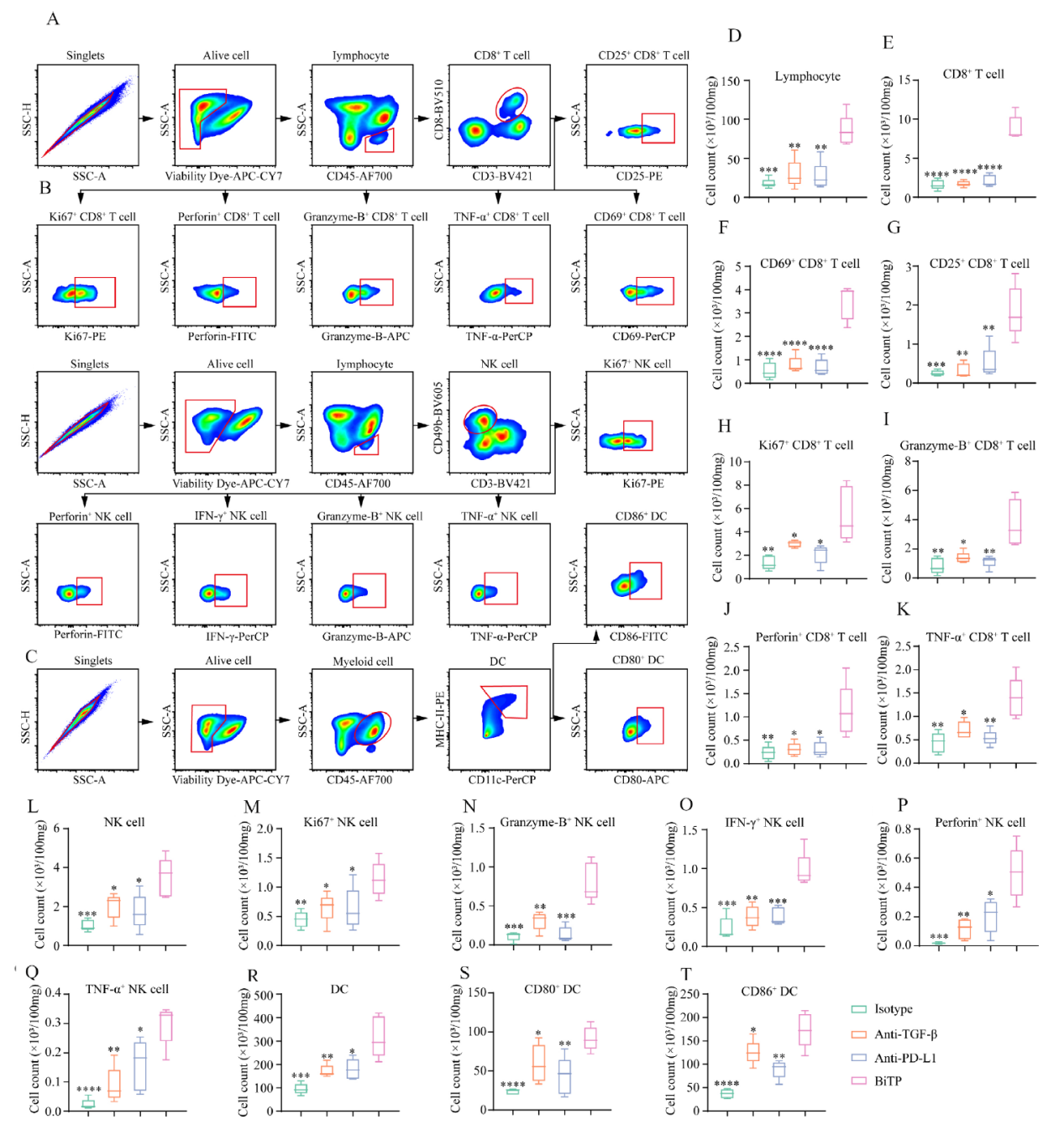
作者收集了4T1-hPDL1组织,通过流式细胞术检测免疫细胞群体的变化(如下图A-C)。结果显示与其他三组相比,BiTP显著增加和活化了多种T细胞和NK细胞(如下图D-Q)。除TIL,BiTP还扩大了总DC细胞和成熟DC细胞量(如下图R-T)。
7.Bulk RNA-seq解析肿瘤微环境(TME)状态
为了探究BiTP增强抗肿瘤活性的机制,作者在康测科技使用4T1-hPDL1样本进行UID RNA-seq测序(更准确的RNA-seq定量结果),结果显示不同比较组分别鉴定到了2144(BiTP vs hIgG)、2211(BiTP vs TGF-β抗体)和709(BiTP vs PD-L1抗体)个基因(如下图 A)。
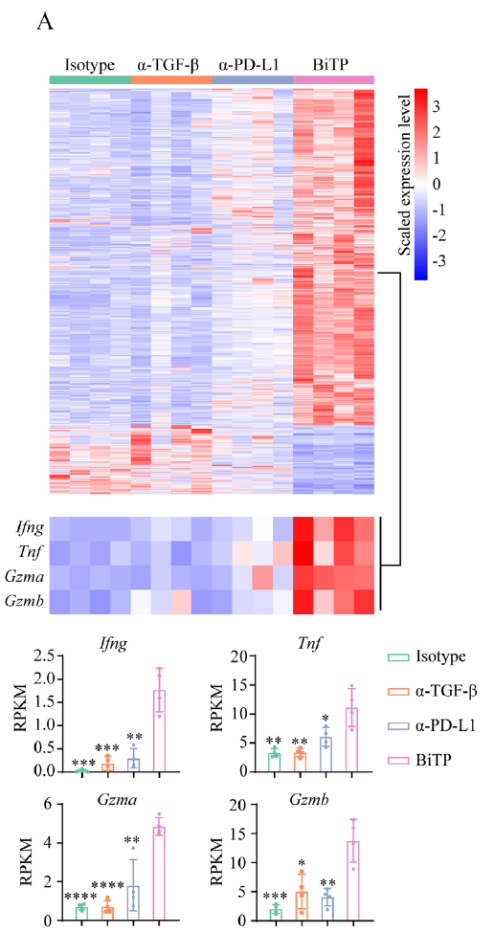
将三个比较组差异基因取交集,得到总共598个交集基因(其中566个上调,32个下调)。KEGG富集分析显示三组交集差异基因与免疫激活高度相关(如下图a-d)。
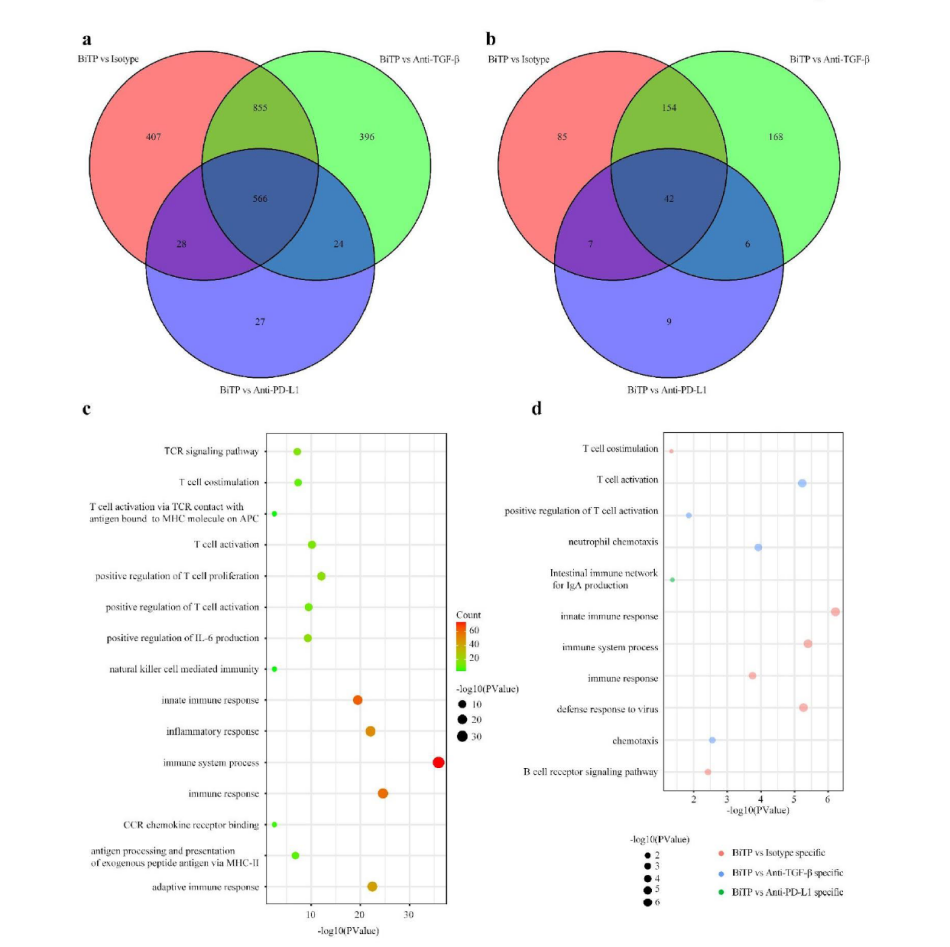
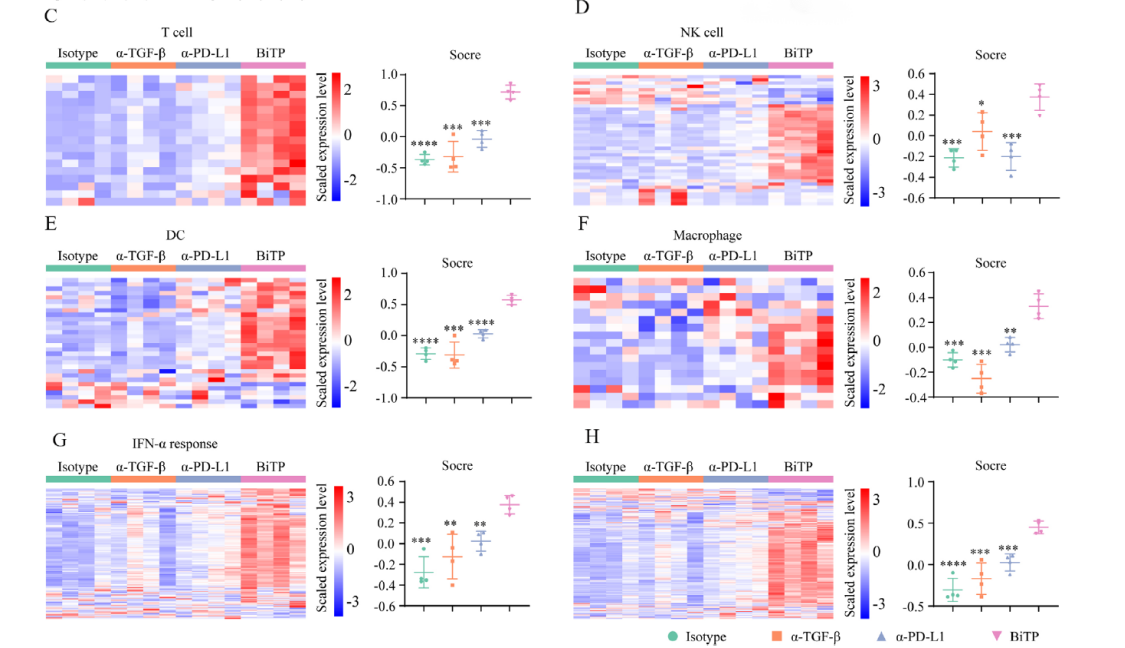
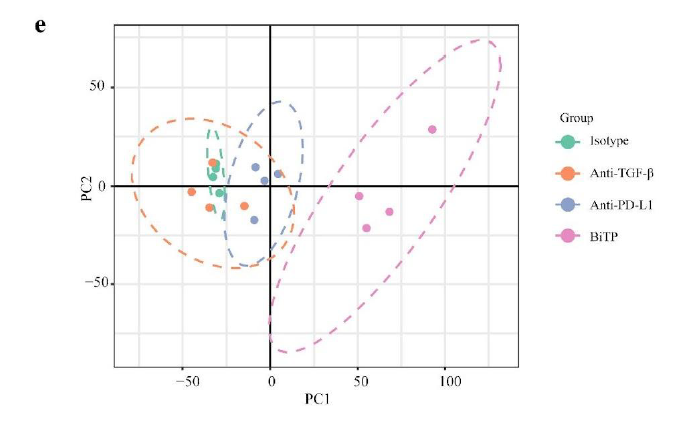
正如预期的那样,一些与免疫杀伤相关基因如Ifng、Tnf、Gzma、Gzmb的表达水平在BiTP处理的样本中显著上调。通过6个免疫特征综合评价了BiTP对TME的影响,结果显示在BiTP处理的样品中,所有免疫特征的评分最高(如下图C-H)。此外,PCA分析显示使用hIgG,TGF-β抗体和PD-L1抗体治疗的肿瘤具有相似的表达模式,而使用BiTP治疗的肿瘤的基因表达模式完全不同(如下图e)。这些结果说明TGF-β抗体和PD-L1抗体单一治疗的免疫刺激作用较弱,被抑制的抗肿瘤免疫力无法完全恢复,因此BiTP可以系统增强多种免疫成分并增强抗肿瘤免疫力。
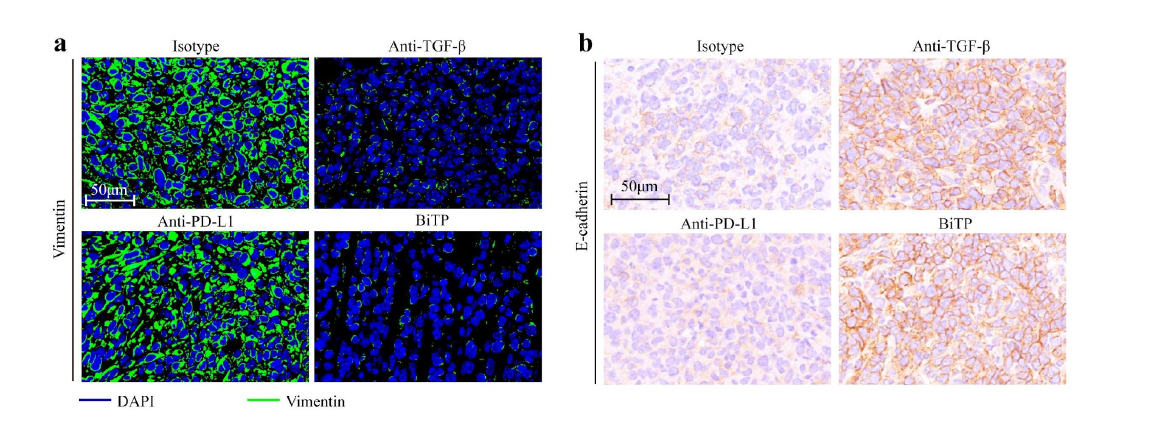
8.BiTP可以逆转EMT过程
最后,作者评估了BiTP治疗后4T1-hPDL1模型中的EMT状态,结果显示BiTP在体内可有效逆转EMT过程(如下图a,b)。
总结
1.设计和构建了靶向TGF-β和PD-L1的双特异性抗体BiTP;
2.评估BiTP的抗体结合能力、药物代谢动力学参数和生物活性;
3.通过EMT小鼠模型初步确认BiTP具有抗肿瘤活性;
4.免疫染色确定BiTP可以减少胶原蛋白形成并促进T细胞浸润;
5.流式结果显示BiTP处理后免疫细胞群体数量明显增多,暗示肿瘤微环境已发生改变;
6.通过UID RNA-seq确认肿瘤微环境中免疫细胞相关基因表达水平均上调,说明微环境已变成抗肿瘤状态,最后确认EMT过程也可以被BiTP所抑制。
2.评估BiTP的抗体结合能力、药物代谢动力学参数和生物活性;
3.通过EMT小鼠模型初步确认BiTP具有抗肿瘤活性;
4.免疫染色确定BiTP可以减少胶原蛋白形成并促进T细胞浸润;
5.流式结果显示BiTP处理后免疫细胞群体数量明显增多,暗示肿瘤微环境已发生改变;
6.通过UID RNA-seq确认肿瘤微环境中免疫细胞相关基因表达水平均上调,说明微环境已变成抗肿瘤状态,最后确认EMT过程也可以被BiTP所抑制。
Yi M, Wu Y, Niu M, et al. Anti-TGF-β/PD-L1 bispecific antibody promotes T cell infiltration and exhibits enhanced antitumor activity in triple-negative breast cancer.Journal for ImmunoTherapy of Cancer 2022;10:e005543.
DOI:10.1136/jitc-2022-005543