Nat Cell Biol:糖尿病疗法新靶点!(2)
444 人阅读发布时间:2023-04-21 15:20
- HASTER调控人胰腺祖细胞中的HNF1A
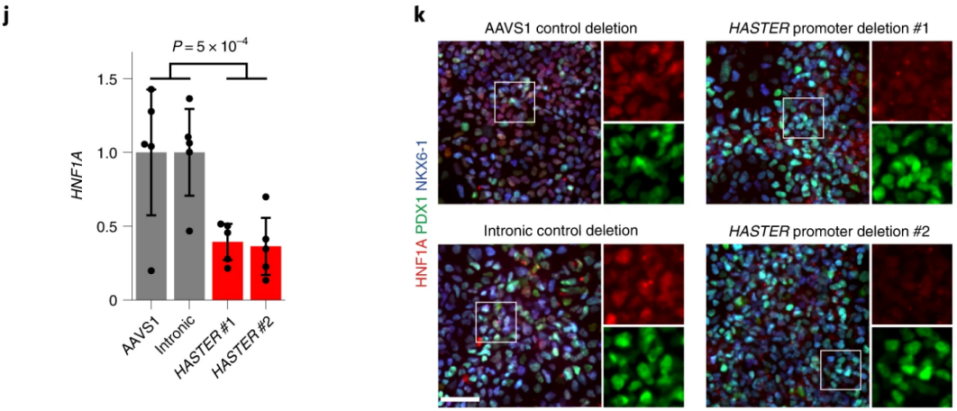
作者后续又测试了人类胰腺祖细胞中的HASTER功能,用HASTER P1缺失的hESC克隆生成胰腺祖细胞,HASTER敲除的胰腺祖细胞显示HNF1A mRNA减少62%,并且异质性的HNF1A蛋白水平较低(下图j,k),这与肝分化后显示HNF1A mRNA增加的结果相反,表明HASTER在胰腺祖细胞中也能作为HNF1A的正调控因子。
- HASTER启动子顺式激活HNF1A
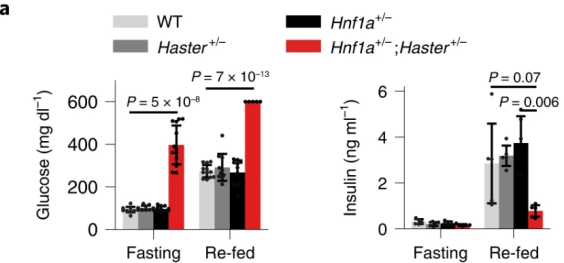
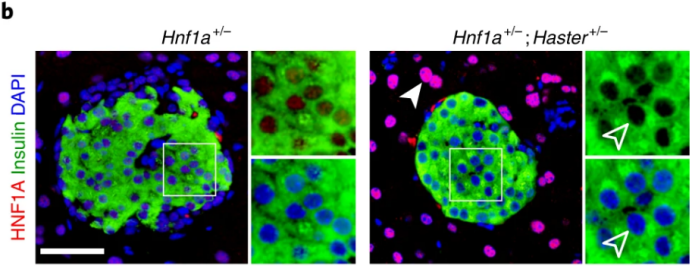
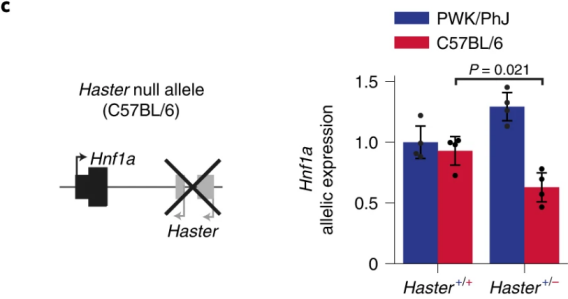
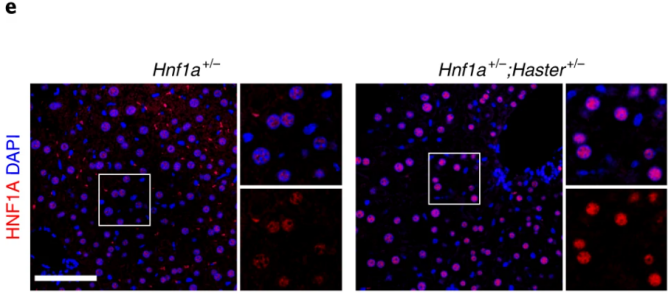
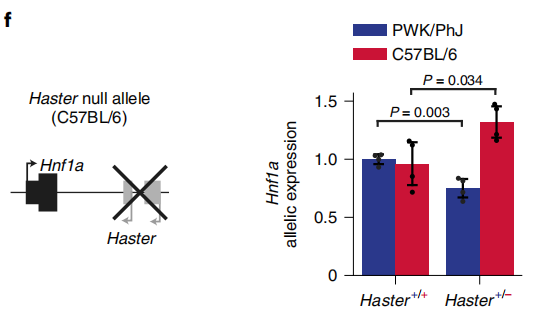
接下来,作者探讨了HASTER如何对HNF1A进行正调控和负调控。为了评估HASTER是顺式还是反式作用,作者培育了Hnf1a+/-;Haster+/-小鼠模型。与人类Hnf1a突变相反,单一杂合子的小鼠不会出现高血糖的症状(下图a)。复合杂合子小鼠表现出明显的高血糖伴低胰岛素血症,但在纯合Hnf1a突变的小鼠中在胰腺之外没有明显特征,在这一过程中大多数10周龄Hnf1a+/-;Haster+/-小鼠β细胞中都伴随着HNF1A的表达缺失(下图b)。由于野生型Haster等位基因不能激活野生型Hnf1a,杂合Haster无效等位基因小鼠上胰岛Hnf1a表达降低,这表明在胰岛细胞中Haster可以顺式正向调节Hnf1a(下图c)。因此,Haster以顺式作用维持胰岛β细胞中Hnf1a的表达。
- HASTER顺式抑制HNF1A
那么HASTER是如何对HNF1A进行负调控的呢,作者再次检测Hnf1a+/-;Haster+/-小鼠的肝脏,发现Haster缺失会导致HNF1A表达上升。复合杂合子表明Hnf1a在肝脏细胞中升高,表明携带Haster缺失的染色体中Hnf1a+等位基因的表达增加不能被Hnf1a-;Haster+等位基因补偿(下图e)。在杂交Haster+/-小鼠肝脏中,Hnf1a在Haster突变的染色体中选择性增加(下图f)。这表明与激活相同,HASTER依赖性顺式抑制HNF1A。
- HASTER启动子对抑制HNF1A至关重要
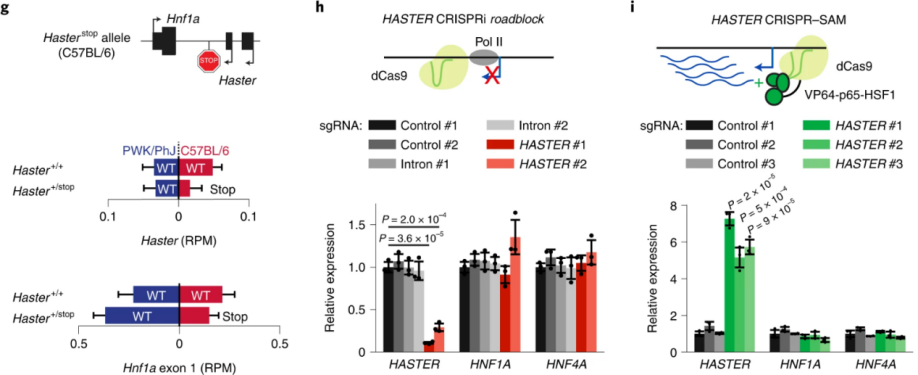
确认了HASTER对Hnf1a的顺势调控作用之后,作者把重点放在检测HASTER转录延伸、RNA或其启动子在这种顺式抑制功能中的作用。Hasterstop杂合品系小鼠的检测结果表明,启动子引起的转录阻断不会导致肝脏中Hnf1a 1号外显子转录增加(下图g)。
为了研究HASTER转录的作用,作者将Cas9靶向HASTER转录起始位点,或者位于HASTER和HNF1A启动子之间的一个控制内含子区域(图5h)。结果表明,靶向HASTER启动子抑制了HASTER RNA的形成,但不影响HNF1A mRNA或HNF4A(HNF1A依赖性转录基因)。反过来,小鼠或人β细胞系中CRISPR–dCas9–SAM激活会导致HASTER转录使其RNA水平增加五倍以上,而不会改变HNF1A或HNF4A mRNA(图5i)。因此表明,HASTER启动子而不是转录调节或转录延伸对HNF1A产生抑制作用。
- HASTER抑制HNF1A需要HNF1A结合到HASTER
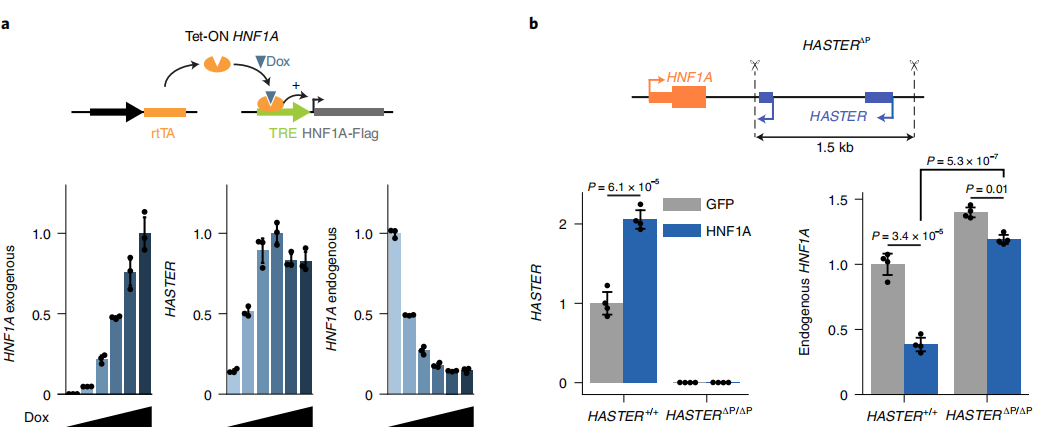
前期遗传学研究表明HNF1A依赖的HASTER转录与HNF1A负调控之间存在密切相关性。为了弄清这一点,作者通过慢病毒四环素诱导过表达HNF1A来激活HASTER(下图a)。除了HASTER上调以外,作者还发现内源性HNF1A mRNA降低了十倍。并且在敲除HASTER启动子后,HNF1A过表达的抑制作用几乎完全消除(下图b)。这表明,HNF1A的抑制是由HNF1A与HASTER启动子DNA 的相互作用特异性触发的,而不是由影响HASTER转录的其他操作引起的。
结论
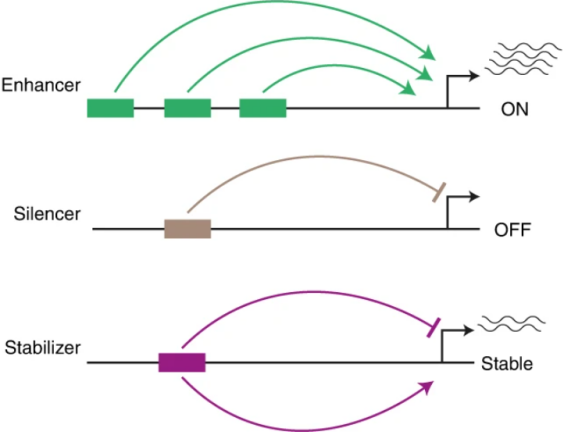
本研究发现了一种能感应HNF1A浓度并能实时反馈以确保其细胞特异性表达水平的顺式调节元件,它是一种不同于增强子和沉默子的顺式作用稳定剂,能通过双重激活和抑制开关防止作用对象过度表达和沉默(下图)。这一发现为剖析HNF1A单倍型糖尿病的细胞特异性遗传机制提供了线索。
Beucher, A., Miguel-Escalada, I., Balboa, D. et al. The HASTER lncRNA promoter is a cis-acting transcriptional stabilizer of HNF1A. Nat Cell Biol 24, 1528–1540 (2022). https://doi.org/10.1038/s41556-022-00996-8