公司新闻/正文
polyA RNA m6A甲基化修饰的发生机制
人阅读 发布时间:2021-04-23 16:32
研究背景和待解决的科学问题
N6-甲基腺苷(m6A)mRNA修饰是mRNA中最普遍的修饰,参与基因转录后调控,并且在各种正常和病理过程中都起着至关重要的作用。
甲基转移酶复合物(MTC,m6A methyltransferase complex)由METTL3和METTL14两个核心组分形成二聚体,加上WTAP作为二聚体的co-factor,能识别保守元件RRACH(R:A/G;H:A/C/U),并对其中的A进行甲基化修饰。
为什么m6A甲基化修饰更倾向于发生在mRNA的CDS和3’UTR,特别是终止密码子(stop codon)附近?
共转录(co-transcription)是指伴随转录过程进行的、并非在转录终止之后才进行的RNA修饰加工。近来,有证据提示m6A甲基化修饰很可能是共转录发生,但相关机制还不清楚,亟待解决。
本篇Nature要揭示的主要问题,就是在转录过程中m6A修饰是如何发生的,哪些关键分子起到重要作用,以及为什么m6A甲基化富集位置存在偏好性。

m6A修饰与H3K36me3高度相关
首先,作者比较了meRIP-seq和各种常见组蛋白修饰的ChIP-seq数据,发现69.2%的m6A peaks与H3K36me3重叠(下图a),所以猜测m6A修饰与H3K36me3有关。

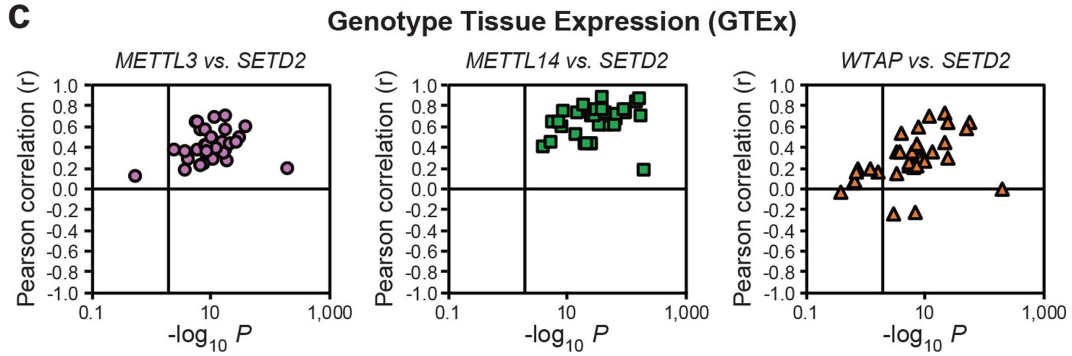
为了控制H3K36me3的水平,作者找到特异性修饰组蛋白H3K36me2成为H3K36me3的甲基化转移酶SETD2,并鉴定其表达量与m6A MTC基因(即METTL3、METTL14和WTAP)的表达量呈正相关(下图c)。
通过敲低SETD2(下图a)或者过表达组蛋白H3K36me3的去甲基化酶KDM4A(下图k),降低了H3K36me3的水平,都导致了polyA RNA m6A修饰下降,其效果与敲低m6A MTC基因相当。在SETD2缺失的细胞中过表达SETD2,能挽救polyA RNA的m6A修饰水平,但过表达SETD2突变体无效(下图b)。说明H3K36me3可能正调控m6A修饰。

然而,沉默m6A MTC基因,并未影响H3K36me3的水平(下图v),表明MTC不影响H3K36me3。

SETD2敲除后,ChIP-seq结果表明,H3K36me3的水平全局降低(下图a),stop codon区域尤甚(下图e);同时,m6A-seq结果显示,m6A修饰水平全局下降(下图c),下降区域多位于编码RNA(下图j)且在stop codon区域附近富集(下图k),且富集了m6A最常见的保守元件“GGAC”(下图l)。




正常HepG2细胞中ChIP-seq和m6A-seq的数据联合分析发现,H3K36me3和m6A在染色体上的位置高度重合(下图d)。

进一步分析表明,与H3K36me3高相关的m6A峰(H3K36me3+)在终止密码子附近富集,而低相关的m6A峰(H3K36me3-)在起始密码子附近富集(下图d);无m6A修饰的H3K36me3倾向于在CDS和内含子区域(而不是在3'末端)富集(下图e)。

5)~7)的结果表明,m6A修饰的位置偏好性与H3K36me3在染色体上分布高度正相关。
dCas9蛋白是Cas9蛋白的突变体,通过突变失活其内切酶,只保留由gDNA引导进入基因组的能力。因此,CRISPR-dCas9系统提供了一个定点研究转录调控的平台。作者通过该系统,将H3K36me3的去甲基化酶KDM4A/甲基化酶SETD2锚向基因MYC/GNG4,这两个基因主要结合了H3K36me3/H3K36me2,发现H3K36me3的结合水平以及m6A修饰水平均下降(下图g)/上升(下图h)。


以上扎实而细致的实验均表明,H3K36me3与m6A修饰之间存在因果关系。
H3K36me3调控m6A修饰的机制
敲低SETD2降低H3K36me3水平,削弱了m6A MTC蛋白与其靶标mRNA之间的相互作用(下图a),但不影响单个m6A MTC基因的表达(下图b)。这表明H3K36me3在募集MTC修饰RNA中具有作用。


因此,作者猜测H3K36me3能结合MTC蛋白。Co-IP结果表明,H3K36me1和H3K36me2均不与m6A MTC蛋白作用(下图i),但H3K36me3与m6A MTC蛋白之间存在特异性的相互作用(下图j)。

到底是MTC中的哪一个蛋白与H3K36me3结合呢?作者敲低了METTL14,发现MTC与H3K36me3的互作被削弱,但METTL3和WTAP的敲低基本无影响(下图k);在不存在METTL14的情况下,SETD2敲低对m6A减少的影响被大大削弱(下图l)。体外pull-down和凝胶位移实验揭示,H3K36me3与重组METTL14蛋白之间存在直接相互作用(下图b,e,f)。所以,MTC蛋白中,METTL14与H3K36me3相结合。



为了确定METTL14与H3K36me3的结合位点,作者构建了METTL14的不同截短物。IP实验结果表明,在这些截短物中,Δ186–456是可以与H3K36me3相互作用的最短变异体(下图8g,h),氨基酸138-143和153-161对结合非常重要(下图8i)。不过,只有全长METTL14才能恢复METTL14敲除细胞中的m6A丰度(下图8j)。



作者研究了METTL14与RNA结合的情况,CLIP-seq表明METTL14有5,981个潜在RNA结合位点(下图m)。距离分析表明,METTL14的RNA结合位点与H3K36me3和m6A修饰重叠(下图f,g),这确认了METTL14介导了H3K36me3与m6A修饰。


我们知道,RNA聚合酶Pol II转录polyA RNA。作者发现,m6A MTC蛋白与Pol II相结合(下图h)。METTL14与H3K36me3和Pol II共定位于细胞核(下图p),表明H3K36me3对m6A修饰为共转录调控。


作者发现,从染色质新转录的RNA m6A修饰程度高于核质与胞质中的RNA(下图q)。为了理解该过程,作者用Pol II抑制剂5,6-dichlorobenzimidazole-1-β-d-ribofuranoside(DRB)处理了细胞。DRB处理降低了m6A的丰度,但不影响H3K36me3(下图r,s,t)。值得注意的是,DRB处理并未中断METTL14与H3K36me3,染色质或METTL3的相互作用(下图u)。这表明METTL14与H3K36me3的互作与Pol II无关。


H3K36me3通过调控m6A修饰影响干细胞分化
m6A修饰的动态调节对于胚胎干(embryonic stem,ES)细胞的自我更新和分化至关重要。为了确定H3K36me3对m6A RNA修饰的调控是否影响细胞分化,作者构建了强力霉素(doxycycline,Dox)诱导的SETD2敲低小鼠ES细胞模型。
SETD2敲低后,小鼠ES细胞表达了更高水平的多能性因子,例如OCT4(也称为POU5F1),SOX2和NANOG(下图a),而细胞分化的内胚层标记物(即GATA4,GATA6,DAB2和SOX7)的表达被减弱(下图d),这都表明细胞处于初始状态。SETD2敲低与METTL14敲低效果相似(下图g)。



SETD2敲低的小鼠ES细胞中,多能性因子的m6A修饰水平和H3K36me3的结合水平都下降了(下图e,o)。这些基因在分化过程中表达量显著下降,但能通过敲低SETD2部分挽救(下图p),而过表达METTL14则能部分挽救SETD2敲低所引起的分化抑制作用(下图f)。

以上研究表明,SETD2和H3K36me3通过对几个关键多能性基因的m6A修饰,抑制小鼠ES细胞多能性并促进其分化。
综上,作者提出以下模型(下图h):m6A MTC的重要组成部分METTL14,直接读取H3K36me3(与Pol II无关),在Pol II介导的转录延伸过程中,m6A MTC甲基化新转录的RNA。

总结
这篇论文读下来,有一种淋漓畅快的感觉,剥丝抽茧,逐层推进,逻辑严密。通过翔实而细致的实验,作者首次从全基因组和转录组角度,揭示了m6A对RNA以及修饰位点集中在stop codons附近的选择决定机制,阐明了富集于stop codon附近的组蛋白H3K36me3通过招募METTL14,介导了MTC对新转录RNA m6A修饰,证实表观遗传组与表观转录组之间存在密切关联,为表观遗传领域的研究开辟了新的战场。
N6-甲基腺苷(m6A)mRNA修饰是mRNA中最普遍的修饰,参与基因转录后调控,并且在各种正常和病理过程中都起着至关重要的作用。
甲基转移酶复合物(MTC,m6A methyltransferase complex)由METTL3和METTL14两个核心组分形成二聚体,加上WTAP作为二聚体的co-factor,能识别保守元件RRACH(R:A/G;H:A/C/U),并对其中的A进行甲基化修饰。
为什么m6A甲基化修饰更倾向于发生在mRNA的CDS和3’UTR,特别是终止密码子(stop codon)附近?
共转录(co-transcription)是指伴随转录过程进行的、并非在转录终止之后才进行的RNA修饰加工。近来,有证据提示m6A甲基化修饰很可能是共转录发生,但相关机制还不清楚,亟待解决。
本篇Nature要揭示的主要问题,就是在转录过程中m6A修饰是如何发生的,哪些关键分子起到重要作用,以及为什么m6A甲基化富集位置存在偏好性。

m6A修饰与H3K36me3高度相关
首先,作者比较了meRIP-seq和各种常见组蛋白修饰的ChIP-seq数据,发现69.2%的m6A peaks与H3K36me3重叠(下图a),所以猜测m6A修饰与H3K36me3有关。

为了控制H3K36me3的水平,作者找到特异性修饰组蛋白H3K36me2成为H3K36me3的甲基化转移酶SETD2,并鉴定其表达量与m6A MTC基因(即METTL3、METTL14和WTAP)的表达量呈正相关(下图c)。

通过敲低SETD2(下图a)或者过表达组蛋白H3K36me3的去甲基化酶KDM4A(下图k),降低了H3K36me3的水平,都导致了polyA RNA m6A修饰下降,其效果与敲低m6A MTC基因相当。在SETD2缺失的细胞中过表达SETD2,能挽救polyA RNA的m6A修饰水平,但过表达SETD2突变体无效(下图b)。说明H3K36me3可能正调控m6A修饰。

然而,沉默m6A MTC基因,并未影响H3K36me3的水平(下图v),表明MTC不影响H3K36me3。

SETD2敲除后,ChIP-seq结果表明,H3K36me3的水平全局降低(下图a),stop codon区域尤甚(下图e);同时,m6A-seq结果显示,m6A修饰水平全局下降(下图c),下降区域多位于编码RNA(下图j)且在stop codon区域附近富集(下图k),且富集了m6A最常见的保守元件“GGAC”(下图l)。




正常HepG2细胞中ChIP-seq和m6A-seq的数据联合分析发现,H3K36me3和m6A在染色体上的位置高度重合(下图d)。

进一步分析表明,与H3K36me3高相关的m6A峰(H3K36me3+)在终止密码子附近富集,而低相关的m6A峰(H3K36me3-)在起始密码子附近富集(下图d);无m6A修饰的H3K36me3倾向于在CDS和内含子区域(而不是在3'末端)富集(下图e)。

5)~7)的结果表明,m6A修饰的位置偏好性与H3K36me3在染色体上分布高度正相关。
dCas9蛋白是Cas9蛋白的突变体,通过突变失活其内切酶,只保留由gDNA引导进入基因组的能力。因此,CRISPR-dCas9系统提供了一个定点研究转录调控的平台。作者通过该系统,将H3K36me3的去甲基化酶KDM4A/甲基化酶SETD2锚向基因MYC/GNG4,这两个基因主要结合了H3K36me3/H3K36me2,发现H3K36me3的结合水平以及m6A修饰水平均下降(下图g)/上升(下图h)。


以上扎实而细致的实验均表明,H3K36me3与m6A修饰之间存在因果关系。
H3K36me3调控m6A修饰的机制
敲低SETD2降低H3K36me3水平,削弱了m6A MTC蛋白与其靶标mRNA之间的相互作用(下图a),但不影响单个m6A MTC基因的表达(下图b)。这表明H3K36me3在募集MTC修饰RNA中具有作用。


因此,作者猜测H3K36me3能结合MTC蛋白。Co-IP结果表明,H3K36me1和H3K36me2均不与m6A MTC蛋白作用(下图i),但H3K36me3与m6A MTC蛋白之间存在特异性的相互作用(下图j)。

到底是MTC中的哪一个蛋白与H3K36me3结合呢?作者敲低了METTL14,发现MTC与H3K36me3的互作被削弱,但METTL3和WTAP的敲低基本无影响(下图k);在不存在METTL14的情况下,SETD2敲低对m6A减少的影响被大大削弱(下图l)。体外pull-down和凝胶位移实验揭示,H3K36me3与重组METTL14蛋白之间存在直接相互作用(下图b,e,f)。所以,MTC蛋白中,METTL14与H3K36me3相结合。



为了确定METTL14与H3K36me3的结合位点,作者构建了METTL14的不同截短物。IP实验结果表明,在这些截短物中,Δ186–456是可以与H3K36me3相互作用的最短变异体(下图8g,h),氨基酸138-143和153-161对结合非常重要(下图8i)。不过,只有全长METTL14才能恢复METTL14敲除细胞中的m6A丰度(下图8j)。



作者研究了METTL14与RNA结合的情况,CLIP-seq表明METTL14有5,981个潜在RNA结合位点(下图m)。距离分析表明,METTL14的RNA结合位点与H3K36me3和m6A修饰重叠(下图f,g),这确认了METTL14介导了H3K36me3与m6A修饰。


我们知道,RNA聚合酶Pol II转录polyA RNA。作者发现,m6A MTC蛋白与Pol II相结合(下图h)。METTL14与H3K36me3和Pol II共定位于细胞核(下图p),表明H3K36me3对m6A修饰为共转录调控。


作者发现,从染色质新转录的RNA m6A修饰程度高于核质与胞质中的RNA(下图q)。为了理解该过程,作者用Pol II抑制剂5,6-dichlorobenzimidazole-1-β-d-ribofuranoside(DRB)处理了细胞。DRB处理降低了m6A的丰度,但不影响H3K36me3(下图r,s,t)。值得注意的是,DRB处理并未中断METTL14与H3K36me3,染色质或METTL3的相互作用(下图u)。这表明METTL14与H3K36me3的互作与Pol II无关。


H3K36me3通过调控m6A修饰影响干细胞分化
m6A修饰的动态调节对于胚胎干(embryonic stem,ES)细胞的自我更新和分化至关重要。为了确定H3K36me3对m6A RNA修饰的调控是否影响细胞分化,作者构建了强力霉素(doxycycline,Dox)诱导的SETD2敲低小鼠ES细胞模型。
SETD2敲低后,小鼠ES细胞表达了更高水平的多能性因子,例如OCT4(也称为POU5F1),SOX2和NANOG(下图a),而细胞分化的内胚层标记物(即GATA4,GATA6,DAB2和SOX7)的表达被减弱(下图d),这都表明细胞处于初始状态。SETD2敲低与METTL14敲低效果相似(下图g)。



SETD2敲低的小鼠ES细胞中,多能性因子的m6A修饰水平和H3K36me3的结合水平都下降了(下图e,o)。这些基因在分化过程中表达量显著下降,但能通过敲低SETD2部分挽救(下图p),而过表达METTL14则能部分挽救SETD2敲低所引起的分化抑制作用(下图f)。

以上研究表明,SETD2和H3K36me3通过对几个关键多能性基因的m6A修饰,抑制小鼠ES细胞多能性并促进其分化。
综上,作者提出以下模型(下图h):m6A MTC的重要组成部分METTL14,直接读取H3K36me3(与Pol II无关),在Pol II介导的转录延伸过程中,m6A MTC甲基化新转录的RNA。

总结
这篇论文读下来,有一种淋漓畅快的感觉,剥丝抽茧,逐层推进,逻辑严密。通过翔实而细致的实验,作者首次从全基因组和转录组角度,揭示了m6A对RNA以及修饰位点集中在stop codons附近的选择决定机制,阐明了富集于stop codon附近的组蛋白H3K36me3通过招募METTL14,介导了MTC对新转录RNA m6A修饰,证实表观遗传组与表观转录组之间存在密切关联,为表观遗传领域的研究开辟了新的战场。