公司新闻/正文
不同免疫细胞受刺激后为啥应答不同?ATAC-seq和RNA-seq联用揭示染色质构象调控因子
人阅读 发布时间:2021-07-22 17:29

研究背景和待解决的科学问题
骨髓来源的免疫细胞利用Toll样受体(Toll-like Receptor, TLR)对微生物的配体进行识别和反应。虽然特定转录因子可以影响特定TLR信号通路的转导结果,但是不同免疫细胞谱系对TLR刺激的反应是否不同?如果是,对TLR刺激反应的不同是否能够决定炎症反应的程度?通过对多种TLR配体刺激的人源单核细胞、单核细胞起源的巨噬细胞(MDM)和单核细胞起源的树突状细胞(MDDC)进行RNA-seq,作者发现了多种免疫细胞对TLR特异性应答。单核细胞对TLR7/8的刺激具有超应答的现象,可能与单核细胞中TLR7/8受体的表达量更高有关。虽然MDM和单核细胞中TLR4的表达水平相当,但是,在TLR4刺激下,MDM高表达干扰素刺激基因(Interferon-Stimulated Gene, ISG),而单核细胞中则没有。作者进一步通过ATAC-seq发现IRF1转录因子参与了巨噬细胞TLR4信号通路,IRF1的功能就是促进ISG基因座染色质的开放并启动转录。
因此,本文要解决的科学问题,就是探索髓系免疫细胞谱系差异对不同TLR刺激是否有着不同反应?如果有,机制是什么?
先天免疫系统主要依靠单核巨噬细胞发挥抵抗外源微生物入侵的作用,包括单核细胞、巨噬细胞以及树突状细胞(DC)等。单核细胞来源于骨髓,可以分化成组织常驻型或炎症型巨噬细胞和树突状细胞。单核细胞、单核细胞起源的巨噬细胞(MDM)和单核细胞起源的树突状细胞(MDDC)共同介导基础先天免疫的过程。
单核细胞、MDM和MDDC均表达多种模式识别受体(Partern Recognition Receptor, PRR),这些受体可以识别结合多种类型的微生物配体。TLR是一种被研究最透彻的PRR。结合了配体后,TLR首先会招募适体(adaptor)蛋白,受体激活后会引发信号转导,并激活NF-κB或干扰素调节因子(IRF)来诱导细胞因子、趋化因子和I型干扰素基因的表达。每一种TLR下游的特异性反应是由适体蛋白的种类与其激活转录因子的类型共同决定的。
有些研究报道了基因不同的染色质结构及其染色质调控因子,和信号通路以及转录因子协作,共同产生细胞特异性和刺激特异性的反应。另外一些研究报道了染色质开放程度可以决定炎症反应的程度。这些研究共同说明染色质可及性(Chromatin accessibility)在炎症反应中起作用。但是谱系特异性的炎症反应的机制是什么?为此,作者开展了研究。
研究内容
1. 髓系免疫细胞对不同TLR刺激的反应情况
为了研究骨髓来源的免疫细胞谱系对TLR信号转导谱系特异性反应的基础,作者首先把单核细胞诱导分化成MDM和MDDC,并在下图各个时间节点进行RNA-seq,发现在开始诱导分化的3天以内,基因表达模式发生显著改变;接着在4-7天中,各类型细胞逐渐开始形成稳定的表达模式。这说明主导分化的一些转录因子在诱导分化早期调控了谱系特异性基因的表达和维持,从而决定细胞分化命运。

观察到这一现象后,作者自然地想到这三种细胞在转录组上的巨大改变是否会导致这些细胞对不同PRR刺激产生截然不同的反应?为了验证这一想法,作者接着进行TLR刺激实验(如下图),通过TLR受体激活剂促使这三种类型细胞中的TLR1/2/6(激活剂Pam3CSK4)、TLR4(激活剂lipopolysaccharide, LPS)、TLR7(激活剂R837)、TLR7/8(激活剂R848)受体激活。

通过RNA-seq,作者将三种细胞互相比较鉴定到的所有差异基因分为8个Clusters,其中Cluster I、II、III中的基因在三种细胞中均不受TLR刺激所影响,主要是一些决定和维持细胞谱系特征的基因。而Cluster IV、V、VI中的基因代表各细胞对TLR刺激谱系特异性的反应,与TLR刺激的种类无关。这些结果表明炎症反应的一个共同节点是在TLR信号转导启动后发生的,而且不同的反应类型差异由不同细胞的谱系来决定,而不是TLR刺激的种类。
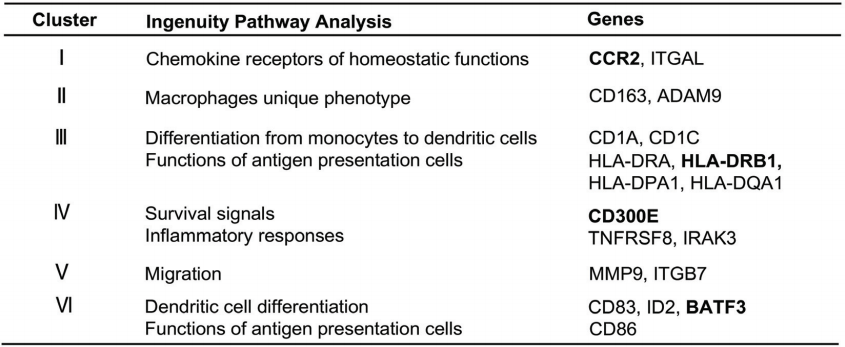
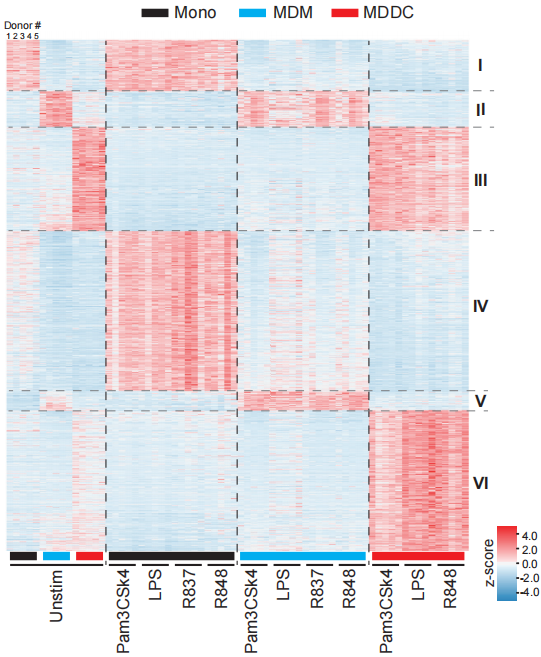
排除了决定细胞谱系以及对TLR刺激具有谱系特异性反应的基因(Cluster I-VI)之后,作者着眼于对不同种类TLR刺激产生特异性反应的基因类型(Cluster VII)。Cluster VII中的基因主要是单核细胞(而非MDM和MDDC)受TLR8刺激后诱导表达的基因,比如一些细胞因子和趋化因子基因IL1B、IL6和CCL3。虽然TLR2、TLR4和TLR7的刺激也能诱导这些基因的表达,但是TLR8刺激的诱导表达量比TLR2、TLR4和TLR7刺激高1个数量级,说明TLR8刺激是诱导Cluster VII基因表达的主要因素。


2. TLR8受体的激活诱导单核细胞中细胞因子和趋化因子基因的表达
虽然作者初步确定了TLR8是诱导Cluster VII基因表达的主要因素,但是使用的TLR激活剂(R848)可以同时将TLR7/TLR8受体激活,TLR7与TLR8有着相似的结构、不同的功能,为了排除TLR7潜在的影响,作者使用单独激活TLR8受体的激活剂(TL8-506)和TLR7/8受体共同激活剂(R848)对比单独激活TLR7受体的激活剂(R837)刺激单核细胞,检测IL-6蛋白分泌水平,发现TLR8和TLR7/8刺激诱导IL6基因表达水平远高于TLR7刺激,而且Cluster VII中的其它基因也同时受TLR8和TLR7/8刺激后被诱导表达。这些结果共同证明单核细胞对TLR8刺激具有独特的敏感性,从而可以引发更严重的促炎症反应。

为什么单核细胞对TLR8刺激具有独特的敏感性呢?作者发现,TLR8在单核细胞中表达量是MDM和MDDC的4-8倍,而这种差异刚好就是在单核细胞分化成MDM和MDDC时发生的。

至此,作者完成了单核细胞对TLR8刺激具有独有敏感性机制的证明,结论是高水平表达的TLR8受体与细胞因子表达水平升高有关,TLR8表达的水平逐步下调是在单核细胞分化成MDM和MDDC过程中发生的。
3. MDM受TLR4刺激后,可以诱导ISG相关基因持续表达
研究完7个Clusters后,作者对Cluster VIII中的基因诱导情况进行总结,主要是ISG相关基因,例如MX1,OAS1和IFIT3。这些基因在MDM中被TLR4刺激诱导高表达,在MDDC中被诱导低表达,而在单核细胞中没有被诱导表达。虽然Cluster VIII在单核细胞中不被TLR4刺激诱导表达,但是在TLR7和TLR7/8受体激活剂刺激下也可以启动ISG的应答。

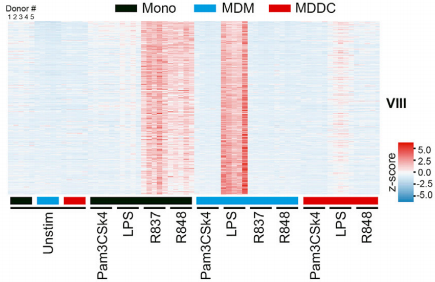
为了进一步确认,作者又用急性白血病单核细胞系THP-1重复了之前的工作。THP-1细胞系被广泛用于单核细胞和巨噬细胞的功能和信号通路研究,分化后的THP-1细胞具有MDM的表型。作者发现对比未分化的THP-1细胞,具有MDM表型的THP-1细胞在接受TLR4刺激后,Cluster VIII中有113/227基因被诱导表达,GSEA分析显示ISG相关基因被诱导高表达,与之前MDM结果保持一致。

这些结果支持了骨髓来源的免疫细胞的不同分化方向会对TLR刺激产生完全不同的反应的结论。作者提出:不是TLR表达量差异,而是TLR4刺激后下游事件的不同,导致单核细胞和MDM ISG基因诱导表达模式的不同。
至此,作者已经回答了开始问题的前半部分:髓系细胞谱系差异对不同TLR刺激确实有不同反应。为了研究下游事件调控细胞对TLR刺激的不同反应的表观调控机制,作者开展了进一步研究。
4. 单核细胞和MDM染色质可及性与受TLR刺激后IFNB1和ISG相关基因的诱导表达状态一致
TLR4刺激会导致IRF3磷酸化并转移至细胞核,核内的IRF3结合在基因的调控元件上,促进IFNB1的表达以及ISG的初级反应。随后IFN-β可以通过IFN-α/βR-ISG因子3(ISGF3)复合物进行顺式和反式信号转导,并放大信号致使ISG的二级反应,促进相关基因的表达。根据这一点,作者之前发现MDM在TLR4激活剂刺激1 h后可以诱导IFNB1的表达,但是不能在单核细胞中诱导表达;相比之下,TLR7/8激活剂刺激可以诱导单核细胞IFNB1以及其他IFNA基因亚型的表达,但是不能在MDM中诱导IFNA基因表达。根据TLR4信号通路下游事件的种类(如下图红圈部分),作者在受TLR4刺激后的MDM和单核细胞中检测了IRF3或NF-κB的激活情况。

作者发现在单核细胞和MDM中,IRF3磷酸化程度并没有显著差别,这说明诱导ISG相关基因表达不能用IRF3的区别性激活来解释。和IRF3类似,通过IκB磷酸化检测,NF-κB激活程度也没有显著差异。
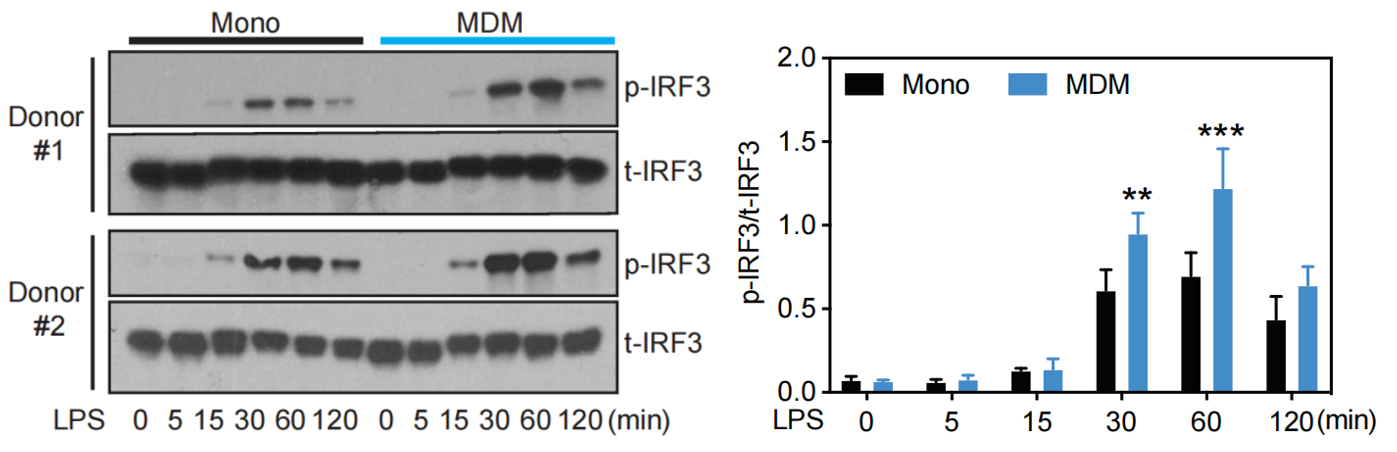
此外,作者发现TLR4激活剂刺激1 h后,MDM中IFNB1、RSAD2和IFITM3基因表达量显著升高,而在单核细胞中,这些基因几乎没有表达。这说明尽管IRF3在单核细胞中激活了,却不能诱导IFNB1和ISG相关基因的表达。

到这里就会产生一个疑问,到底是什么影响了MDM和单核细胞对TLR4刺激反应的不同?由于组蛋白修饰以及染色质构象可以影响转录因子的结合并调控转录,作者假设单核细胞和MDM中ISG相关基因区域的染色质可及性的不同会影响IRF3的结合。为了验证这一假设,作者在TLR4刺激后的0 h、1 h、6 h和18 h不同时间节点进行ATAC-seq和RNA-seq,结果显示刺激1 h后,对比单核细胞,MDM中IFNB1、RSAD2和IFITM3基因的启动子区和gene body区,染色质可及性都有所增加,这与mRNA表达水平升高的结果保持一致。

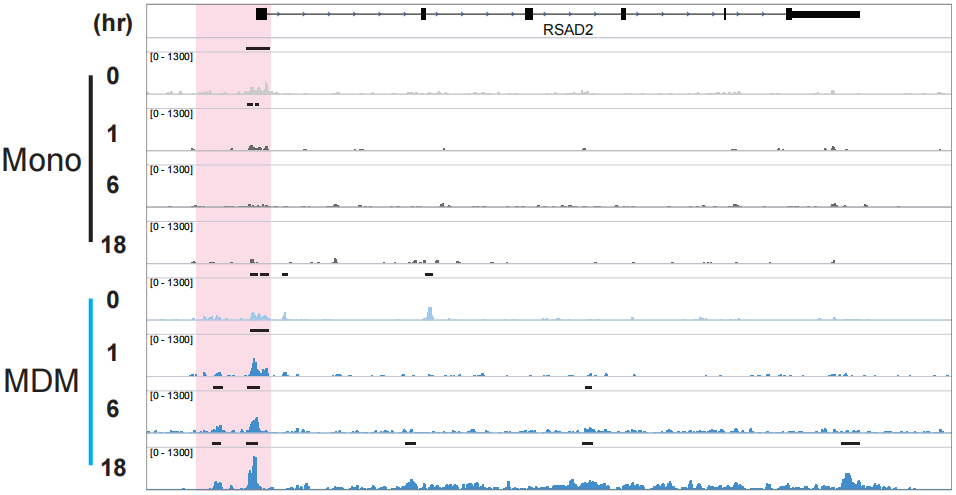
作者观察到MDM中IFNB1、RSAD2和IFITM3这些基因所处的染色质区域更加开放;观察所有ISG相关基因,发现经过TLR4刺激1 h后,MDM中几乎所有ISG相关基因的启动子区域染色质都变得更加开放,因而在刺激后的6 h和18 h时间节点,这些基因的mRNA水平显著升高。相反,单核细胞ISG相关基因所在区域的染色质开放程度和mRNA水平并没有发生明显变化。

得到ISG相关基因染色质开放图谱后,作者产生了一个疑问,IFNB1在刺激1 h后可以激活IFN-a/bR-ISGF3通路诱导ISG相关基因的转录,但无法解释在TLR4刺激1 h后,ISG相关基因启动子区域染色质开放程度已经发生了改变。因此,若刺激后0-1 h之间的ISG相关基因启动子区域染色质处于开放状态,就意味着ISG基因座可以在早期发生染色质重塑,从而直接促进ISG相关基因的转录。总体来说,这些数据共同说明,MDM和单核细胞是在染色质可及性上的变化——而不是早期强烈的信号转导过程——最终导致这两种细胞对TLR4刺激有着截然不同的反应。
5. IRF1的motif在MDM开放染色质中出现的概率增加,而且IRF1蛋白从胞质转运至核内的事件增多
作者在前一步得知染色质开放程度的不同导致MDM和单核细胞对TLR4刺激反应的不同的结果后,很自然地假设:造成MDM染色质重塑的现象一定有某种转录因子的参与,而且在单核细胞中这一过程是缺失的。众所周知,ATAC-seq对Peak序列的motif分析可以找到哪些转录因子起主效调控作用,因此作者利用HOMER软件扫描开放区域(即Peaks)序列中各转录因子已知的motif,结果表明MDM中开放染色质具有更多IRF家族转录因子的结合motif。

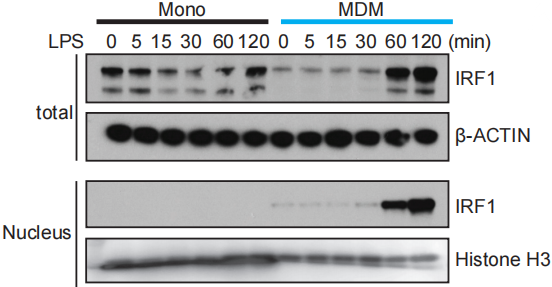
在IRF家族转录因子成员中,IRF1转录因子的motif在MDM染色质开放区域中有更显著的富集。随后作者检测了IRF1的蛋白水平,发现MDM随着TLR4开始刺激,IRF1转录因子蛋白水平立刻上升,而单核细胞中的IRF1蛋白水平则稳定维持在一个较低的水平。另外,由WB图下半部分内容可以发现,MDM受TLR4刺激30-60 min时间段中,IRF1核内定位明显增加,说明IRF1活化并转运至细胞核内的事件增多。这些结果共同表明在受TLR4刺激后的MDM中,IRF1对维持ISG相关基因的染色质可及性起到关键作用。

6. IRF1的缺失会导致ISG相关基因染色质可及性和表达水平的下降
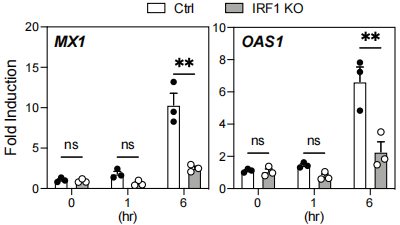
为了确认IRF1在调控染色质可及性中的功能,作者使用之前的THP-1细胞系,通过CRISPR/Cas9系统敲除IRF1基因,获得了IRF1-KO THP-1细胞。随后作者将IRF-KO细胞和Ctrl细胞一起分化成与MDM表型类似的细胞,并用TLR4刺激后,在1 h和6 h检测ISG相关基因的表达量。果不其然,分化后的IRF1-KO THP-1细胞失去了在TLR4刺激下诱导ISG相关基因表达的能力。值得注意的是,IRF1的缺失并不会阻碍TLR7/8刺激后诱导ISG相关基因的表达,这说明不同种类的TLR刺激有着不同染色质结构调节因子来诱导相关基因集的表达。
通过ATAC-seq联合RNA-seq检测IRF1-KO细胞中ISG基因座染色质可及性和表达水平变化,发现结果与此前一致:相比Ctrl细胞,IRF1-KO细胞中ISG相关基因的表达水平整体下降,而且ISG相关基因的启动子区域染色质可及性也全面降低。

综上所述,在TLR4刺激后的巨噬细胞中,IRF1是诱导ISG相关基因染色质重塑过程中的关键调节因子。
至此,作者的研究回答了开始问题的后半部分:IRF1即是MDM中区别于单核细胞对TLR刺激反应不同的原因。
总结
- 通过RNA-seq检测髓系免疫细胞对不同TLR刺激的反应情况,并把所有差异基因分为8个Cluster;
- Cluster VII是单核细胞对TLR8刺激具有独特敏感性的证据;
- Cluster VIII是MDM对TLR4刺激具有独特敏感性的证据;
- 染色质可及性的差异,而非下游事件(IRF3、NF-κB)的差异,导致单核细胞和MDM对不同TLR刺激反应的不同;
- 通过ATAC-seq发现IRF1是MDM中调节ISG相关基因染色质重塑的关键调节因子;
- ATAC-seq和RNA-seq联合分析一起揭示IRF1可以调节染色质构象致使MDM和单核细胞对不同TLR刺激反应的不同。