公司新闻/正文
RNA m6A修饰与免疫——病毒的m6A修饰,助其逃逸宿主先天免疫识别
人阅读 发布时间:2021-08-26 10:24

- 研究背景
本研究所关注的科学问题,就是探究病毒RNA上的m6A修饰是否影响病毒对宿主的侵染过程。若m6A修饰在此过程中发挥作用,究竟是促进侵染、还是抑制侵染?其具体的调控机制又是怎样的?
1. 人偏肺病毒(hMPV)基因组上存在m6A修饰
作者以人偏肺病毒(hMPV)这一单股负链RNA病毒为模型,探索m6A修饰是否在hMPV侵染的过程中发挥作用。该病毒mRNA的产生如下图所示,负链的基因组RNA可直接转录出mRNA,也可先产生互补配对的反基因组RNA,再产生互补的负链基因组RNA,最后转录出mRNA。

作者首先对纯化的hMPV病毒total RNA进行了m6A-seq(剔除rRNA的方式富集RNA),发现病毒的基因组、反基因组上均有m6A修饰(下图a)。

为了了解病毒mRNA上的m6A修饰状况,作者对hMPV侵染的细胞也进行了m6A-seq(polyA捕获的方式富集RNA),结果显示hMPV的mRNA上存在m6A修饰,且mRNA上发生m6A修饰的区域与其反基因组上发生m6A修饰的区域高度重合(下图b)。

2. m6A促进hMPV相关基因表达、复制
既然hMPV上存在m6A修饰,那么这一修饰在病毒侵染宿主的这一过程中发挥了什么作用呢?。
m6A修饰被相应的甲基化阅读蛋白识别后,影响下游靶标的转录、翻译等过程,因此作者在A549细胞系中分别瞬时表达多个甲基化阅读蛋白(YTHDF1, YTHDF2, YTHDF3, and YTHDC1),甲基化阅读蛋白超表达后,病毒G、N蛋白的表达显著上调(下图c),病毒粒子的释放也明显增多(下图d)。HeLa细胞系中稳定超表达上述甲基化阅读蛋白的结果也与之一致。这些结果初步表明,m6A修饰对病毒侵染宿主有促进作用。

为了更进一步验证上述结果,作者又超表达了甲基化转移酶(METTL3, METTL14),甲基化转移酶的过表达同样有助于hMPV的复制(下图f)及其G、N蛋白表达(下图g);而敲除去甲基化酶(ALKBH5, FTO)的效果是一样的。这些结果再次表明,m6A修饰有助于hMPV的复制、有助于病毒侵染宿主。

此外,作者还发现hMPV的N蛋白同宿主的甲基化酶METTL14存在共定位(下图h),而N蛋白是核糖核蛋白的组分,在病毒复制中发挥重要作用。

3. m6A修饰的缺陷抑制hMPV的增殖,且促进了宿主的IFN水平
为了继续验证m6A修饰在病毒侵染中所发挥的作用,作者将病毒基因组、反基因组及mRNA上潜在的m6A修饰位点进行了同义突变,得到6个rhMPV突变体:rhMPV-G1-2, G1-7, G8-9, G8-14, G1-14和rhMPV-G(-)1-6,且通过meRIP定量发现,这些rhMPV突变体上的m6A修饰水平显著下降(下图b)。此外,rhMPV-G1-14和rhMPV-G8-14突变体反基因组RNA与甲基化阅读蛋白YTHDF1, YTHDF2的结合能力也大幅下降(下图c)。

不仅如此,这些具m6A缺陷的rhMPV突变体产生的免疫斑点更小(下图a),病毒的复制存在缺陷(下图b),其N、G蛋白的表达量也更低(下图c)。这些都表明,hMPV病毒的m6A缺陷抑制了病毒在宿主细胞中增殖。


作者通过mRNA-seq发现,在hMPV侵染后,先天免疫相关基因显著上调(下图c),且m6A缺陷的突变体病毒侵染宿主细胞(A549, THP-1)时,细胞分泌的干扰素(IFN-I)明显增多(下图d, f)。


m6A缺陷的突变体病毒引发宿主更高水平IFN-I,究竟是hMPV病毒基因组,反基因组,还是其mRNA的m6A修饰在上述过程中发挥了关键作用呢?作者先提取了被病毒侵染细胞的总RNA并用其转染细胞,相较于对照组rhMPV而言,rhMPV-G1-14和rhMPV-G8-14突变体能引发更高水平的IFN(下图i),且当经小牛肠碱性磷酸酶(CIP)处理后(CIP可使RNA去磷酸化),不再产生IFN。而当用病毒的mRNA转染宿主时,仅能引发和阴性对照相当的IFN水平(下图j),表明是hMPV病毒基因组、反基因组——而非mRNA——上的m6A修饰缺乏,引发了更高水平的IFN。

随后,作者直接用纯化的病毒RNA转染细胞,各m6A缺陷的突变体均能引发较高的IFN水平,rhMPV-G1-14突变体引发的IFN水平最高(下图l)。这也印证了之前的结论,hMPV病毒基因组、反基因组上m6A修饰缺陷引发了更高水平的IFN。

4. RIG-I在宿主对病毒的识别过程中发挥重要作用
究竟是哪些RNA传感器检测m6A缺陷病毒的RNA呢?作者测量了已知的RNA传感器MDA5, RIG-I及衔接蛋白MAVS敲除细胞受病毒侵染时的IFN水平,结果发现,在野生型细胞中,rhMPV-G8-14和rhMPV-G1-14突变体引发的IFN-β水平比rhMPV高得多(下图a),MDA5敲除细胞的表型也与野生型细胞一致(下图b),但当RIG-I或MAVS被敲除后,不论是rhMPV-G8-14, rhMPV-G1-14突变体还是rhMPV,均不引发IFN-β的产生(下图c, d)。


用病毒RNA转染细胞,表型也与病毒侵染的结果一致:在野生细胞、MDA5敲除细胞中,rhMPV-G8-14, rhMPV-G1-14突变体引发的IFN-β显著上调(下图e, f),但当RIG-I或MAVS被敲除后,rhMPV-G8-14, rhMPV-G1-14突变体引发的IFN-β与rhMPV较为接近(下图g, h)。这些都表明RIG-I在检测m6A缺陷病毒并激活IFN-I产生中发挥重要作用。

接下来作者发现,不论是用rhMPV-G8-14, rhMPV-G1-14突变体病毒侵染细胞(下图a),还是用rhMPV-G8-14, rhMPV-G1-14突变体的RNA转染细胞(下图b),细胞中RIG-I的蛋白表达均显著上调。

不过,当病毒RNA经CIP酶处理后再转染细胞时,RIG-I的表达不上调(下图d)。上述结果表明,具m6A缺陷的RNA可促进RIG-I的表达,且这种促进表达的作用依赖于病毒RNA 5’端的三磷酸。
为了研究I型IFN相关的信号级联是否被激活,作者检测了hMPV病毒侵染(下图e)或病毒RNA转染(上图d)的细胞,发现在各m6A缺陷的突变体病毒侵染下,细胞中IRF3蛋白S386, S396的磷酸化水平明显上调;而用CIP处理病毒的RNA转染细胞后,其IRF3不再发生磷酸化。这些表明,m6A缺陷hMPV病毒可引发更高水平的IRF3磷酸化,进而引发下游IFN-I的分泌。

4.1 RIG-I更易结合具m6A缺陷的病毒
既然m6A缺陷的hMPV病毒使得宿主中RIG-I表达上调,那么这些病毒的侵染是否会改变病毒RNA与RIG-I的结合能力呢?作者利用生物素标记的病毒RNA结合RIG-I发现,rhMPV-G8-14, rhMPV-G1-14突变体病毒的RNA与RIG-I蛋白的亲和力更高(下图a);Flag标记的RIG-I蛋白拉病毒RNA,结果也表明RIG-I蛋白结合了更多rhMPV-G8-14, rhMPV-G1-14病毒反基因组(下图c)。这些实验均证明,具m6A缺陷的病毒RNA与RIG-I蛋白的亲和力更强。
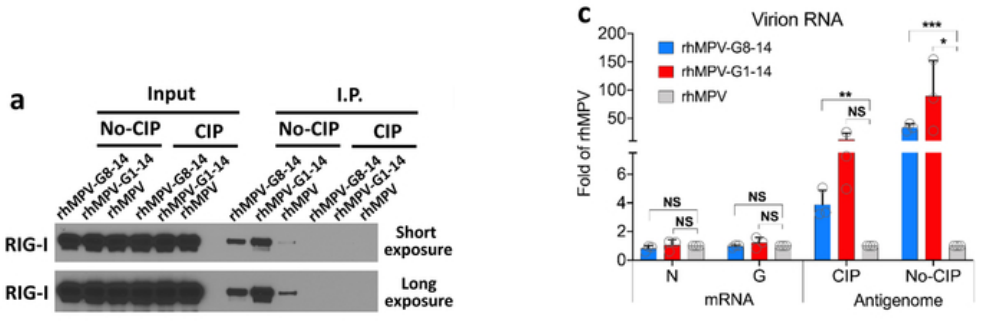
体内的RNA竞争结合实验结论一致:随着rhMPV-G1-14突变体RNA的增多,结合的RIG-I蛋白也随之增多(下图e)。

4.2 m6A缺陷的病毒RNA使RIG-I蛋白的构象发生变化
作者猜测m6A缺陷的hMPV病毒会使RIG-I蛋白的构象发生变化,从而激活下游IFN表达。为了验证这一猜想,作者用胰蛋白酶对RIG-I:RNA复合物进行酶解。当无配体RNA存在时,经胰蛋白酶处理的RIG-I(107kDa)产生了55 kDa的肽段(helicase domain) (下图h);而当双链RNA类似物poly(I:C)存在时,经胰蛋白酶处理RIG-I 会产生80 kDa的肽段(CARD-Helicase domain)(下图i)。当野生型病毒RNA处理时,RIG-I酶解产生几乎不产生80 kDa的肽段,而rhMPV-G8-14, rhMPV-G1-14病毒RNA存在时,RIG-I经胰蛋白酶酶解产生更多80 kDa的肽段(下图j)。竞争实验也表明,随着rhMPV-G1-14病毒RNA的增多,RIG-I在胰蛋白酶处理下产生的80 kDa的肽段更多(下图k)。
这些结果表明,m6A修饰阻碍了RIG-I蛋白对病毒RNA的识别,而m6A缺陷的hMPV能与RIG-I蛋白结合,并改变了蛋白构象(下图g)。

综上,hMPV病毒RNA 5’端的三磷酸是RIG-I结合所必需的;m6A修饰降低RNA传感器RIG-I蛋白的亲和力,而m6A缺陷病毒能使RIG-I蛋白构象改变,使下游IFN的表达增强。
5. m6A缺陷病毒在RIG-I突变体中复制能力得以恢复
为了更好的证实RIG-I蛋白可以识别hMPV病毒RNA,作者进行了挽救实验:rhMPV-G1-14和rhMPV-G8-14突变体病毒在野生型细胞中出现严重的生长缺陷(下图a);而在RIG-I(下图c)或MAVS(下图d)敲除细胞中,rhMPV-G1-14突变体的生长可恢复至野生型相当水平,尽管早期复制有所延迟,rhMPV-G8-14突变体的生长也有部分恢复;相反,rhMPV-G1-14和rhMPV-G8-14突变体在MDA5敲除细胞中的生长能力同在野生型细胞中类似,并无显著变化(下图b)。这些进一步证实,RIG-I而非MDA5可识别具m6A缺陷的hMPV病毒RNA,并抑制了缺陷病毒的复制。


6. m6A缺陷的hMPV病毒在体内引发的更多IFN
体内实验也证明,m6A缺陷的hMPV病毒可使细胞产生更多的IFN:在棉鼠鼻腔中接种hMPV病毒,并对其支气管肺泡进行灌洗发现,接种有PBS或rhMPV病毒的棉鼠体内IFN-β低于检测水平,而接种有rhMPV-G1-14、rhMPV-G8-14突变体病毒的棉鼠体内IFN-β分别为150.2、175.3 U/ml(下图e)。这一体内实验也表明,m6A缺陷的hMPV病毒可使宿主产生更多的IFN。

不论是棉鼠肺部还是鼻甲中,rhMPV-G1-2、rhMPV-G8-9、rhMPV-G1-14突变体的复制均受到抑制(下图f)。不仅如此,突变体病毒造成的肺部损伤更少(下图g)。这些结果表明,m6A缺陷hMPV病毒在棉鼠体内的复制能力明显降低,且致病力也被大幅削弱。


那么m6A缺陷hMPV病毒是否还具有免疫原性呢?实验表明,不论接种的是野生型hMPV病毒还是m6A缺陷hMPV病毒,再次接种病毒均可保护宿主,抑制病毒的复制(下图h)。此外,在接种2周时,m6A缺陷的hMPV病毒能使棉鼠产生更高水平的抗体(下图i)。这表明,m6A缺陷的hMPV病毒的免疫原性与野生型病毒相当,甚至更高,可保护宿主免受后续的hMPV病毒感染。

综上所述,本研究得到以下模型:hMPV病毒基因组或反基因组上的m6A修饰可助其“伪装”成宿主自身的RNA,逃逸宿主的识别,助其感染宿主;而m6A缺陷的hMPV的RNA会被宿主的RNA传感器RIG-I识别,并激活一系列先天免疫的信号通路,引发高水平的IFN产生,阻止病毒的复制和感染。此外,病毒RNA的m6A修饰可作为减活hMPV的潜在靶点,用于疫苗的研制。

参考文献:
[1] Lu M , Zhang Z , Xue M , et al. N6-methyladenosine modification enables viral RNA to escape recognition by RNA sensor RIG-I[J]. Nature Microbiology, 2020, 5(4):1-15.