公司新闻/正文
转录因子保持染色质开放维持干细胞干性
人阅读 发布时间:2021-12-06 10:50

研究背景和待解决的科学问题
生物体需要成体干细胞 (Stem Cell,SC) 来制造和修复组织。SCs自我更新和分化的平衡对于组织的维系和再生都至关重要。平衡状态下,局部微信号和表观遗传调节因子协同作用,建立了稳定的基因表达模式,维持SC的身份和功能。扰动微环境(例如受伤)会触发 SC调控程序的快速重新编程,使它们能够应对压力并恢复组织稳态。因此,SC对其所处微环境非常敏感,通过基因表达微调,在体内实现高精度分化、发育和修复。
但是,成体SCs是如何建立和维持转录调控回路的呢?转录程序如何响应环境扰动、如何再回复稳态呢?目前都不太清楚。而这与组织修复、衰老、疾病进展都高度相关,因为SC平衡功能障碍会导致组织退化和/或肿瘤发生。
小鼠毛囊为研究成体SCs提供了理想模型(如下图)。皮肤 SCs 位于上皮-间质交界,来自局部微环境的信号决定了它们何时被激活以及将形成什么组织。伴随毛发每个再生周期,位于毛囊基底部的处于静止期的毛囊干细胞会被瞬间激活,完成自我更新,促进毛囊再生和毛发生长。

在胚胎干细胞中,与细胞全能性相关的关键基因受到主转录因子(master TF)调控,这些转录因子协同结合在大型开放染色质区域,这些区域后被命名为超级增强子(Super enhancer, SE),超级增强子区域一般伴随稳定的H3K27ac和H3K4me1修饰。和胚胎干细胞类似,静止期的毛囊干细胞也会表达一系列结合超级增强子的转录因子来调控和维持干细胞特性的关键基因。部分转录因子中,包括SOX9、LHX2、TCF3/4等,已经被研究得很透彻。虽然NFI家族的转录因子早已报道可以结合超级增强子,但是缺失NFIB却对毛囊干细胞的功能没有影响,同时NFI家族的另一位成员NFIX的表达水平显著提高,暗示着NFIB和NFIX的功能可能存在冗余。
本文需要解决的问题是:毛囊干细胞中NIFB和NFIX转录因子的作用是什么?是否对维持干细胞特性有着作用?为了搞清楚NFIB和NFIX是否具有维持毛囊干细胞身份的功能,以及它们的功能是否冗余,作者开展了以下研究。
研究内容
1. NFIB和NFIX在毛囊干细胞中功能冗余
定位于超级增强子区域内的转录因子基因通常具有通过结合超级增强子实现自我调控表达的能力。作者对已有的毛囊干细胞H3K27ac以及NFIB ChIP-seq的数据进行了分析,辅以ATAC-seq数据,发现NFIB基因座处于超级增强子区域中(下图),而且富集NFIB的motif,这说明NFIB可以通过结合超级增强子来调控自我表达。
虽然NFIB单独缺失并不会出现明显的表型,但是作者观察到NFIX在NFIB缺失后表达量一直维持较高水平(下图),似乎NFIX高表达挽救了NIFB缺失所导致的表型。

无独有偶,NIFX基因座也处于超级增强子区域中(下图),那么NFIB和NFIX在毛囊干细胞中扮演的角色只会出现两种情形:a. NFIX比NFIB更重要;b. NFIX和NFIB功能冗余。

为了确定到底是那种情况,作者利用Sox9-CreER重组酶构建NFIB或NFIX单敲以及NFIX和NFIB双敲(dKO)小鼠模型(下图)。

单敲NFIB或NFIX的小鼠并没有出现明显变化,而dKO小鼠则在4周后出现脱毛表型,主要表现在毛囊中CD34+K24+干细胞数量减少,其中CD34是毛囊干细胞的marker基因(下图)。


随着NFIB和NFIX的缺失,原先的毛囊干细胞分化异常,这些结果说明NFIB和NFIX在毛囊干细胞中功能冗余。
2. NFIB和NFIX dKO改变了毛囊干细胞的身份
为了进一步探讨两个NFI转录因子对毛囊干细胞稳态方面的影响,作者首先对WT和dKO毛囊干细胞进行了常量mRNA-seq,再与NFIB ChIP-seq数据联合分析,找出NFIB的靶标基因的差异表达情况,结果显示,干细胞特性相关的基因例如Lhx2、Lgr5和Krt24等显著下调;而上调表达的是一些决定表皮细胞谱系分化相关的基因,例如Krtdap和Sca 1等(下图)。
接下来作者又对WT和dKO毛囊干细胞进行了SMART-seq2单细胞转录组测序,细胞聚类结果显示毛囊干细胞数量明显减少,并且变成了其他谱系的细胞(下图)。


总的来说,常量转录组和单细胞转录组结果共同说明早期转录组水平的变化与NFIB/NFIX缺失后毛囊干细胞身份逐渐消失有关,说明毛囊干细胞维持干性依赖于NFIB/NFIX表达。
3. NFIB通过保持相关转录因子基因染色质可及性来维持干细胞干性
为了研究转录水平改变前后的染色质开放程度的变化,作者将WT和dKO两周后的毛囊干细胞进行ATAC-seq。结果显示,对比WT组,dKO组整体损失了~11%(8190 peaks)的染色质可及性(下图),其中3048(37.2%)个peak具有NFIB的motif,说明NFI缺失对这些基因的染色质可及性有直接影响。
分析dKO中染色质失去可及性的部分,通过motif扫描,作者发现这些区域富集了NFIB/NFIX和一些干细胞主转录因子的motif(下图)。

值得注意的是,这些主转录因子基因座在NFIB/NFIX敲除后的早期就失去了染色质可及性,说明这些基因座需要NFIB/NFIX结合以保持染色质开放(下图以Lhx2为例)。

另外一方面,NFI敲除后,40%的超级增强子区域染色质可及性下降了一半以上(下图)。

考虑到NFI对染色质可及性的影响,作者通过ChIP-seq检测了NFI dKO后激活型组蛋白修饰H3K4me1和H3K27ac,以及抑制型组蛋白修饰H3K27me3的情况。对比WT组,H3K27me3的修饰水平在NFI结合的区域没有明显改变,而H3K4me1和H3K27ac修饰水平在这个区域明显降低(下图)。

不仅NFI结合的区域是这样,超级增强子区域中的H3K4me1和H3K27ac修饰水平也明显降低(下图上),导致dKO细胞失去了35%左右的超级增强子,这些超级增强子大多数定位于维持干性相关的基因座中(下图下)。


这些结果共同表明,NFI通过提升主转录因子结合区域、超级增强子区域的染色质开放程度,创造活跃的染色质环境,维持了毛囊干细胞干性。
4. NFI在细胞谱系命运选择中的角色
前文提到,NFI dKO细胞相比WT细胞失去了~11%区域的染色质可及性,但是也增加了~12%区域(9202 peaks)的染色质可及性,但是NFIB的ChIP-seq结果显示,伴随着NFIB的缺失,~80% NFIB结合的区域染色质可及性降低,这说明部分新开放的染色质区域是由其它转录因子驱动的(下图)。这些转录因子与表皮细胞谱系分化有关,而不是毛囊干细胞再生过程中的过渡细胞(短暂扩充细胞,TAC)分化方向的转录因子基因。
作者进一步将染色质可及性增加的区域进行motif扫描,与前面结果一致,KLF5等表皮细胞谱系的转录因子motif排名靠前(下图)。
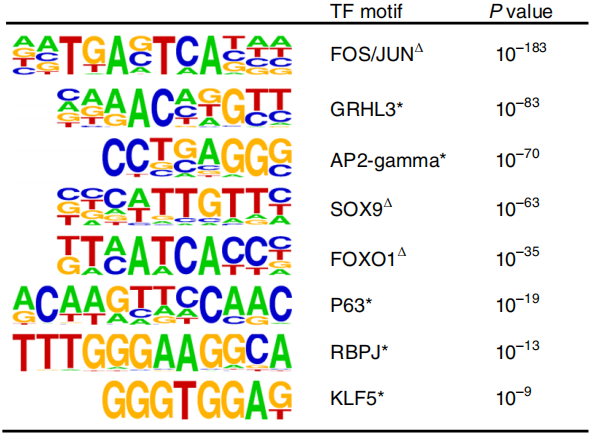
令人意外的是,SOX9的motif也出现在染色质可及性增加的区域,对于毛囊干细胞来说,即使微环境改变,SOX9的表达水平通常也不会发生变化。作者接着进行免疫荧光染色,确认SOX9和KLF5都在NFI dKO细胞中表达(下图)。
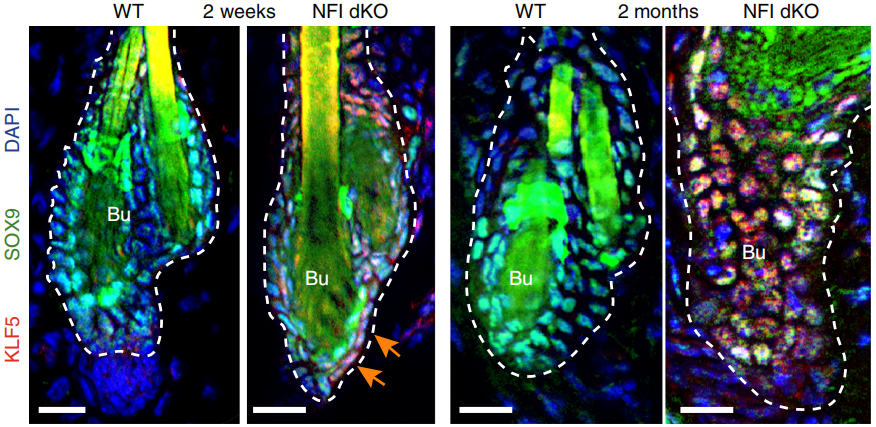
这种情况一般被认为是细胞谱系失真,通常是由创伤/胁迫诱导的状态,而AP1家族(FOS/JUN)和FOXO1等转录因子的出现证实了这种状态。总的来说,缺失NFI的毛囊干细胞数量急剧减少是因为失去了干细胞身份,而不是发生凋亡,最后由于谱系失真转化成其他类型的细胞。
总结
1. 作者构建dKO NFI小鼠,证明NFIB/NFIX功能冗余;
2. 通过常量转录组和单细胞转录组,确定dKO NFI会导致HF干细胞数量显著减少,而且干细胞身份发生改变;
3. 通过联合ATAC-seq和ChIP-seq,确定NFI可以通过保持超级增强子区域染色质可及性以维持毛囊干细胞干性;
4. 缺失NFI会导致毛囊干细胞失去干性,改变分化谱系选择。
文献链接:
https://doi.org/10.1038/s41556-020-0513-0